La Peritonitis Bacteriana Espontánea (PBE) es una infección bacteriana grave del líquido ascítico en pacientes con cirrosis hepática, sin una fuente intrabdominal obvia de infección. Es una complicación frecuente y potencialmente mortal, que requiere de diagnóstico rápido y tratamiento eficaz.
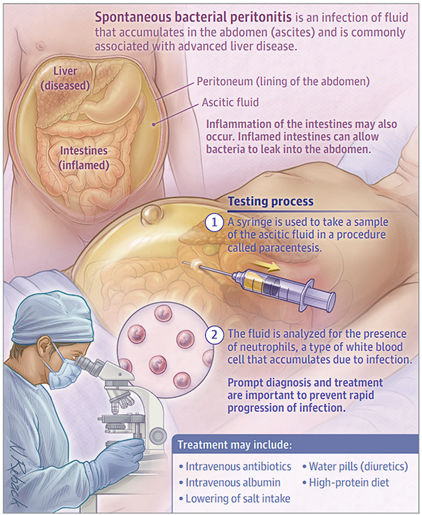
La imagen muestra un esquema ilustrado de Peritonitis Bacteriana Espontánea (PBE), resaltando el proceso de infección y diagnóstico. La ilustración se divide en tres secciones principales:
Anatomía y localización de la infección: En la parte superior izquierda, se observan el hígado enfermo, los intestinos inflamados y el líquido ascítico acumulado en la cavidad abdominal. La ilustración señala el peritoneo (revestimiento del abdomen) y explica que el líquido infectado en el abdomen se asocia con enfermedad hepática avanzada. También se menciona que la inflamación de los intestinos puede permitir el paso de bacterias al abdomen, contribuyendo a la infección.
Proceso de prueba: En el centro de la imagen, se describe el procedimiento de diagnóstico mediante paracentesis. Un médico extrae una muestra de líquido ascítico con una jeringa, y el fluido es analizado en laboratorio para detectar neutrófilos, un tipo de glóbulo blanco que indica infección. Se enfatiza la importancia de un diagnóstico y tratamiento rápidos para evitar la progresión de la infección.
Opciones de tratamiento: En la parte inferior derecha, se indican posibles tratamientos para la PBE, incluyendo antibióticos intravenosos, albúmina intravenosa, diuréticos, dieta alta en proteínas y la reducción de la ingesta de sal.Epidemiología
La PBE afecta aproximadamente al 10-30% de los pacientes hospitalizados con ascitis secundaria a cirrosis. Su prevalencia y mortalidad varían según la población y el grado de disfunción hepática. La PBE suele estar asociada a una alta mortalidad en aquellos con cirrosis avanzada.
Etiología y Patogenia
La mayoría de los casos de PBE son causados por bacterias gramnegativas, como Escherichia coli y Klebsiella pneumoniae, aunque también pueden estar implicadas bacterias grampositivas, como Streptococcus spp. La traslocación bacteriana desde el intestino hacia el líquido peritoneal es el mecanismo patogénico principal.
Diagnóstico
Punción Diagnóstica de Ascitis: Realizar una paracentesis diagnóstica es fundamental en todo paciente con cirrosis y ascitis al ingreso hospitalario o cuando se sospecha infección.
Análisis del Líquido Ascítico: La PBE se confirma cuando:
- Recuento de leucocitos polimorfonucleares (PMN) en el líquido ascítico es ≥ 250 células/µL.
- Cultivo del líquido ascítico es positivo en aproximadamente el 60-80% de los casos.
Bioquímica y Otros Parámetros: Es relevante analizar los niveles de proteínas y glucosa en el líquido ascítico y realizar pruebas adicionales para descartar peritonitis secundaria si los hallazgos son atípicos.
Tratamiento
Antibióticos Empíricos:
- Cefotaxima o una cefalosporina de tercera generación es el tratamiento de elección en PBE. Dosis recomendada: 2 g cada 8 horas por vía intravenosa.
- Alternativas incluyen ceftriaxona o fluoroquinolonas en caso de alergias o resistencia conocida.
Profilaxis Antibiótica:
- En pacientes de alto riesgo de recurrencia o para prevención primaria en cirrosis avanzada, se recomienda profilaxis con norfloxacino o ciprofloxacino.
Tratamiento de Soporte:
- Albumina intravenosa en combinación con antibióticos ha demostrado reducir el riesgo de síndrome hepatorrenal y mejorar la supervivencia en pacientes con disfunción renal concomitante.
Manejo y Prevención
- Profilaxis Secundaria: En pacientes con historia previa de PBE, la profilaxis antibiótica prolongada es necesaria para reducir la recurrencia.
- Evaluación para Trasplante Hepático: Los pacientes que desarrollan PBE tienen peor pronóstico, por lo que es crucial evaluar su elegibilidad para trasplante hepático.
- Educación del Paciente y Seguimiento: Informar al paciente sobre los signos de alerta y la importancia de la adherencia al tratamiento es esencial para reducir complicaciones.
Pronóstico
La PBE tiene una alta tasa de mortalidad en pacientes con cirrosis avanzada, especialmente en aquellos con insuficiencia renal. La intervención temprana y el manejo adecuado son fundamentales para mejorar los resultados clínicos.
Conclusión
La Peritonitis Bacteriana Espontánea es una emergencia médica que requiere de un enfoque multidisciplinario. La comprensión de sus factores de riesgo, su diagnóstico temprano y tratamiento adecuado son claves para optimizar el pronóstico en estos pacientes.
Enlaces de interés
- American Association for the Study of Liver Diseases (AASLD)
Información detallada sobre guías de práctica clínica en enfermedades hepáticas, incluyendo la PBE.
https://www.aasld.org - Sociedad Española de Patología Digestiva (SEPD)
Proporciona guías y recomendaciones específicas para el diagnóstico y tratamiento de la ascitis y PBE.
https://www.sepd.es - UpToDate
Plataforma médica de acceso por suscripción que ofrece información actualizada sobre diagnóstico y tratamiento de la PBE.
https://www.uptodate.com - European Association for the Study of the Liver (EASL)
Publica guías europeas sobre el manejo de cirrosis y sus complicaciones.
https://easl.eu
Artículos y estudios recomendados
- Ginès, P., & Solà, E. (2016). Spontaneous Bacterial Peritonitis in Cirrhosis: Diagnosis, Treatment, and Prevention.
Clinics in Liver Disease, 20(3), 317-329.
Este artículo revisa los últimos avances en el diagnóstico y manejo de la PBE, incluyendo opciones terapéuticas y profilaxis. - Runyon, B. A. (2013). Management of adult patients with ascites due to cirrhosis: An update.
Hepatology, 57(4), 1651-1667.
Este estudio de referencia ofrece guías prácticas sobre el manejo de la ascitis y la PBE en pacientes adultos. - Bernardi, M., et al. (2012). Albumin Administration in Patients with Cirrhosis and Spontaneous Bacterial Peritonitis: Beyond a Simple Volume Expander.
Journal of Hepatology, 57(4), 879-890.
Analiza los efectos de la albúmina en pacientes con cirrosis y PBE y su impacto en la reducción de complicaciones. - European Association for the Study of the Liver (EASL) Clinical Practice Guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis.
Journal of Hepatology, 53(3), 397-417.
Estas guías abarcan el diagnóstico y tratamiento de la ascitis y sus complicaciones, incluyendo la PBE, y ofrecen recomendaciones basadas en la evidencia.
Libros y recursos adicionales
- «Harrison’s Principles of Internal Medicine» – Capítulo sobre cirrosis y sus complicaciones, incluyendo PBE.
- «Liver Disease in Clinical Practice» (3rd Edition) – Health Sciences Series
Capítulos dedicados a la ascitis y el manejo de la PBE en pacientes con cirrosis.




