El mieloma múltiple se caracteriza típicamente por la proliferación neoplásica de células plasmáticas productoras de inmunoglobulina. La mayoría de los pacientes presentan signos o síntomas relacionados con la infiltración de células plasmáticas en el hueso u otros órganos o con daño renal por exceso de cadenas ligeras.
Las presentaciones comunes incluyen anemia, dolor óseo, creatinina elevada o proteína sérica, fatiga e hipercalcemia.
Las presentaciones menos comunes que requieren una evaluación urgente incluyen compresión de la médula espinal, insuficiencia renal aguda, hipercalcemia grave e hiperviscosidad.
Evaluación de casos sospechoso
En pacientes con sospecha mieloma múltiple o trastornos relacionados, las pruebas de detección iniciales apropiadas incluyen una electroforesis de proteínas séricas junto con inmunofijación y un ensayo de cadena ligera libre en suero.
La evaluación adicional para confirmar el diagnóstico de MM incluye una aspiración y biopsia de médula ósea, imágenes, un hemograma completo con diferencial y una prueba química. Una recolección de orina de 24 horas para electroforesis e inmunofijación es importante para cuantificar la proteína monoclonal y la concentración total de proteína en la orina.
La infiltración de la médula ósea con células plasmáticas malignas puede ser focal, requiriendo aspiración/biopsia en múltiples sitios. La resonancia magnética (IRM) y/o la tomografía por emisión de positrones (PET) pueden ser útiles para localizar la enfermedad focal.
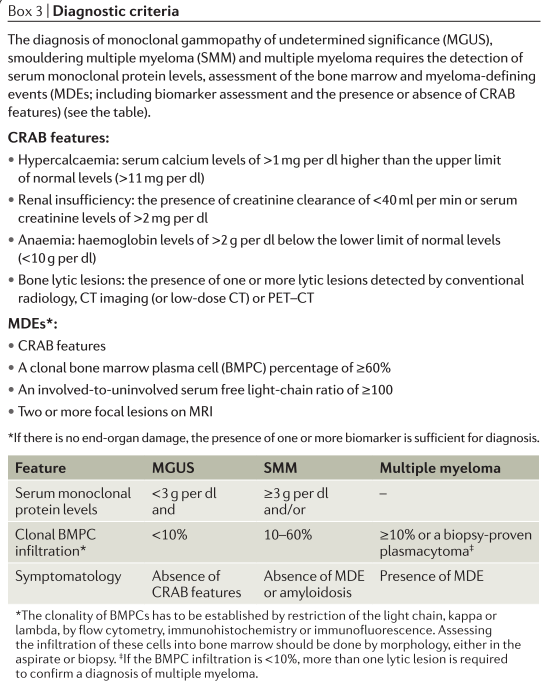
Criterios diagnósticos
≥10 por ciento de células plasmáticas clonales en la médula ósea o plasmacitoma óseo o de tejidos blandos comprobado por biopsia
Además de uno de los siguientes:
Deterioro de órganos o tejidos que puede atribuirse al trastorno proliferativo de las células plasmáticas (por ejemplo, aumento del calcio, insuficiencia renal, anemia, lesiones óseas líticas).
Un biomarcador asociado con una progresión casi inevitable a daño en el órgano final (es decir, ≥60 por ciento de células plasmáticas clonales en la médula ósea; relación FLC involucrada / no involucrada de 100 o más [el nivel de FLC involucrado también debe ser de al menos 100 mg / L o más]; o resonancia magnética con más de una lesión focal).
Diagnóstico diferencial
Las principales condiciones para considerar en el diagnóstico diferencial para MM incluyen Gammapatia monoclonal de significado indeterminado, macroglobulinemia de Waldenström, plasmacitoma solitario, amiloidosis, síndrome de POEMS y carcinoma metastásico.
Consideraciones para el manejo
Verificación del diagnóstico
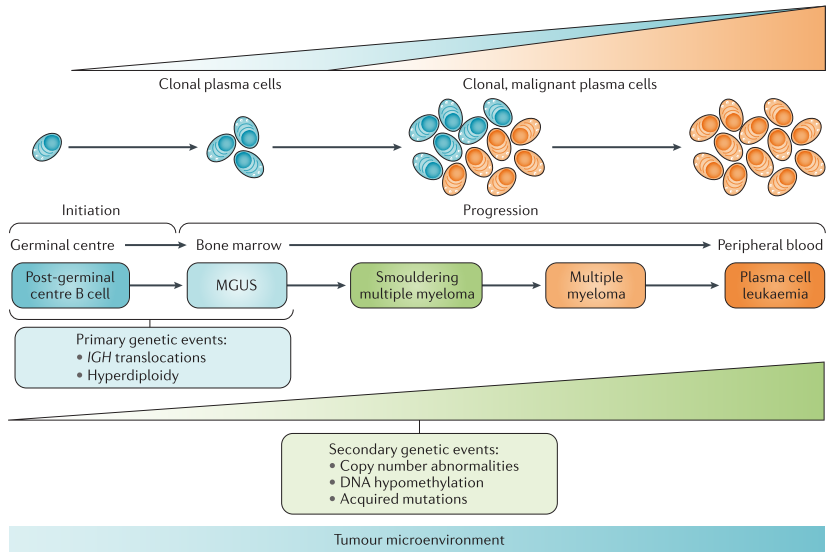
El primer paso para evaluar a un nuevo paciente con MM es verificar el diagnóstico, ya que las etapas premalignas del mieloma, a saber, la gammapatía monoclonal de significado indeterminado (MGUS) y el mieloma múltiple ardiente (SMM), pueden diagnosticarse fácilmente erróneamente como MM si no se tiene cuidado.
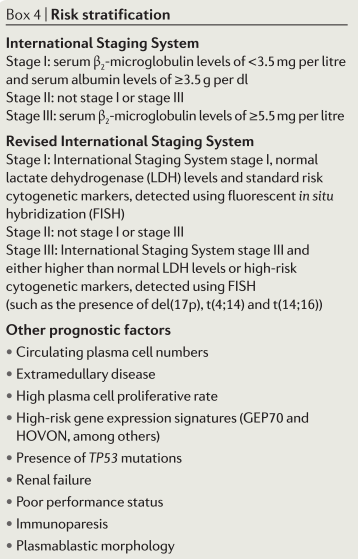
Estratificación del riesgo
Corremos el riesgo de estratificar casos individuales en función de los resultados de la hibridación fluorescente in situ (FISH) para translocaciones específicas y ciertas otras pruebas. Esta estratificación del riesgo tiene un valor pronóstico considerable y también ayuda a guiar la selección de la terapia inicial.
Mieloma de alto riesgo: Incluye pacientes con t(4;14), t(14;16), t(14;20), del17p13 o gain1q por FISH, aquellos con lactato deshidrogenasa (LDH) ≥2 veces el límite superior institucional de lo normal, y aquellos con características de leucemia primaria de células plasmáticas.
Mieloma de riesgo estándar: Incluye pacientes sin ninguna de las anomalías o características citogenéticas de alto riesgo. Esto incluye pacientes con trisomías, t (11;14) y t (6;14).
Determinación de la elegibilidad para el trasplante: todos los pacientes se evalúan para determinar la elegibilidad para el trasplante autólogo de células hematopoyéticas (HCT), que parece prolongar tanto la supervivencia libre de eventos como la supervivencia general en comparación con las estrategias no trasplantadas. La elegibilidad para HCT varía según las instituciones. Aunque se proporcionan directrices, la elegibilidad debe considerar la evaluación de riesgo-beneficio y las necesidades y deseos del paciente.
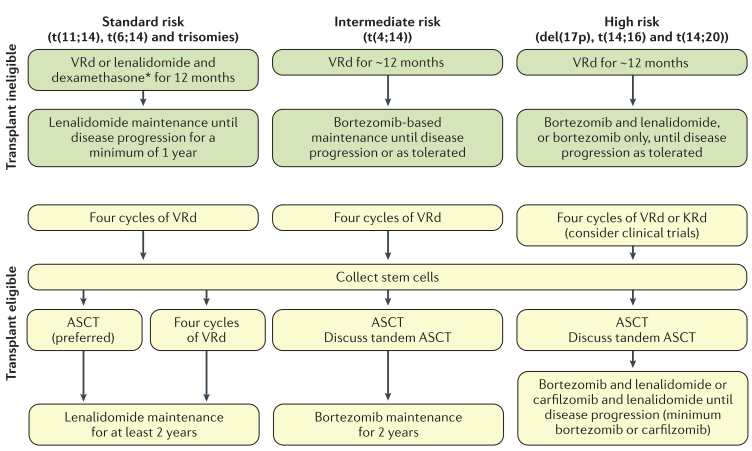
Sin embargo, varios estudios han demostrado resultados similares con ASCT en pacientes mayores, y es probable que la edad fisiológica sea más relevante que la edad cronológica164. El segundo determinante principal es la presencia de comorbilidades; existe un acuerdo más uniforme, que indicaba que a los pacientes con comorbilidades importantes, como cardiopatías y enfermedades pulmonares, no se les debería ofrecer TACM, aunque esto podría modificarse en función de la experiencia del centro. La insuficiencia renal, incluida la necesidad de hemodiálisis crónica, no tiene por qué limitar el uso del TACM, especialmente porque un tercio de los pacientes con mieloma múltiple pueden presentar algún grado de insuficiencia renal.
Finalmente, la preferencia del paciente juega un papel importante en la determinación del uso de ASCT.
Otros factores que determinan el curso del tratamiento incluyen la edad del paciente, su capacidad y/o deseo de someterse a un TACM, la estratificación del riesgo, el estado funcional y la presencia de comorbilidades que podrían aumentar la toxicidad de la terapia. KRd, carfilzomib, lenalidomida y dexametasona; VRd, bortezomib en combinación con lenalidomida y dexametasona. * Indica tratamiento para pacientes ≥75 años o frágiles.