Introducción Miopatías inflamatorias
Miopatías inflamatorias: (sinónimo: miopatía idiopática inflamatoria, IIM, por sus siglas en inglés: miositis) son afecciones poco comunes que pueden afectar a múltiples órganos, aparte del músculo, y que a menudo conducen a un deterioro grave de la calidad de vida. El diagnóstico y el tratamiento son a menudo un desafío, ya que se requieren varias subespecialidades para una atención óptima, incluido el reumatólogo y / o neurólogo, dermatólogo, neumólogo, cardiólogo, fisioterapeuta, etc.
Excepto en el caso de la dermatomiositis clásica (DM), el diagnóstico no suele ser sencillo y, por lo general, requiere pruebas. de autoanticuerpos, evaluación histológica de una biopsia de músculo esquelético y pruebas adicionales que incluyen MRI muscular y EMG. Recientemente se han establecido nuevos criterios de diagnóstico, pero se requerirá una actualización.
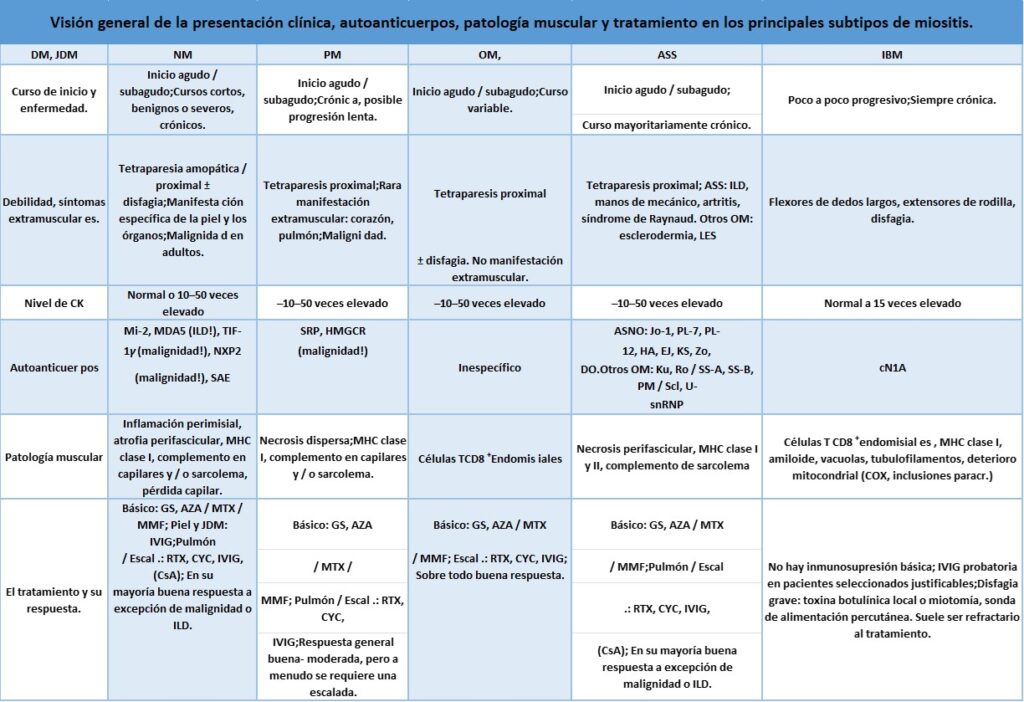
Los síntomas principales de miositis incluyen un inicio agudo (dentro de varios días) o subagudo (dentro de varias semanas) de debilidad de brazos y piernas (consulte la para obtener una descripción general de todos los síntomas en diferentes subtipos de miositis). Las quejas típicas incluyen problemas para caminar y subir escaleras o levantar un objeto por encima de la cabeza. El dolor suele ser un síntoma acompañante y, a excepción de los casos de miositis por cuerpos de inclusión (IBM), la evaluación general de laboratorio generalmente muestra una regulación al alza profunda de la creatina quinasa (CK) de 10 a 50 veces y enzimas hepáticas elevadas como un indicador del daño de las células musculares.
Como se detalla a continuación, es de suma importancia para realizar un diagnóstico confiable y rápido mediante la combinación de resultados clínicos, de anticuerpos y de biopsia y instalar oportunamente el tratamiento apropiado. Después de una descripción general de la epidemiología de la miositis, los siguientes párrafos analizarán cada una de las formas de miositis, incluidos sus hallazgos de autoanticuerpos, histopatología del músculo y asociación con tumores malignos. Las manifestaciones orgánicas extra musculares, los criterios diagnósticos y su abordaje, la fisiopatología y las modalidades de tratamiento actuales se presentarán en párrafos separados.
Epidemiología
Todas las formas de miositis se consideran enfermedades raras: la DM tiene una prevalencia de ½ a 6 pacientes por cada 100.000 personas en los EE. UU.
La miositis superpuesta (OM; sinónimo: síndrome de superposición con miositis) presumiblemente representa el grupo más grande de formas de miositis con hasta la mitad de los casos, seguido de DM con más de un tercio de los casos. En un gran análisis muy reciente de 3067 pacientes del registro de Euromiositis, la DM fue el trastorno más común con 31%.
Se cree que la miopatía necrotizante (NM, también denominada NM mediada por inmunidad inmune, IMNM) es el segundo grupo más grande con una quinta parte de los casos. La epidemiología de la polimiositis (MP) es controvertida, desde la fracción más grande con ∼10 por 100,000 personas en los EE. UU, 27% en el grupo de Euromiositis hasta la condición más rara que solo debe diagnosticarse por exclusión.
Se supone que IBM se produce con una prevalencia de hasta 14 por millón. Los datos epidemiológicos precisos son difíciles de generar y las publicaciones anteriores deben considerarse con cuidado, ya que los criterios de diagnóstico han cambiado significativamente en las últimas décadas (consulte los detalles a continuación). En conjunto, actualmente se cree que OM, NM y DM constituyen el 90% de los casos de miositis. En general, las mujeres se ven afectadas con más frecuencia por miositis y se observa una forma juvenil de DM (DMJ) en niños y adolescentes.
PRESENTACIÓN CLÍNICA, ANTICUERPOS Y HISTOPATOLOGÍA MUSCULAR
Dermatomiositis (DM)
Los pacientes con DM presentan signos de inflamación de la piel, como pápulas de Gottron en los lados dorsales de las manos y los dedos, edema periorbital y eritema de la cara (erupción con heliotropo), la parte superior del tórax anterior (signo V) o El cuello posterior (signo del chal). Aparecen eritema periungico y telangiectasia, así como piel agrietada y engrosada de las partes ventral y dorsal de los dedos y las manos («manos del mecánico»), mientras que esta última es también una característica típica del síndrome de la anti-sintetasa (ASS, ver más abajo).
La inflamación muscular causa una debilidad proximal que puede desarrollarse de forma aguda (dentro de varios días) o subaguda (dentro de varias semanas hasta unos pocos meses). Los pacientes sufren de dificultad para caminar y subir escaleras, así como levantar sus brazos y objetos pesados. El dolor puede estar presente y el análisis de laboratorio generalmente muestra una regulación positiva significativa de las enzimas musculares, como la creatina quinasa sérica (CK), con una elevación de 10 a 50 veces.
Existen varias variantes de la DM clásica, como la DM amiopática (ADM; sinónimo: “DM clínicamente amiopática”, CADM) en la appr. El 20% de los casos, en los que solo se presentan manifestaciones cutáneas pero no hay debilidad de los músculos ni elevación de la CK sérica. Sin embargo, los pacientes con ADM a menudo muestran una afección de los pulmones en forma de una enfermedad pulmonar intersticial (ILD), que indica un fenotipo grave y requiere un tratamiento más agresivo (ver más abajo). La DM adermatopática (» dermatomiositis sinusoidal «) es un síndrome opuesto, en el que la debilidad y los signos histológicos se observan de manera similar a la DM pero sin lesiones inflamatorias de la piel.
Sin embargo, es mucho más probable que la mayoría de estos pacientes estén clasificados erróneamente y que, de hecho, representen casos de síndrome de antisintetasa (ASS) u otras formas de OM (ver más abajo). La JDM afecta a los niños y generalmente se presenta con fiebre y erupción cutánea. La calcinosis de la piel es común en la DMJ y las anormalidades al tragar pueden ocurrir en todas las formas graves de DM. Más detalles de la participación de órganos extramusculares se discuten a continuación.
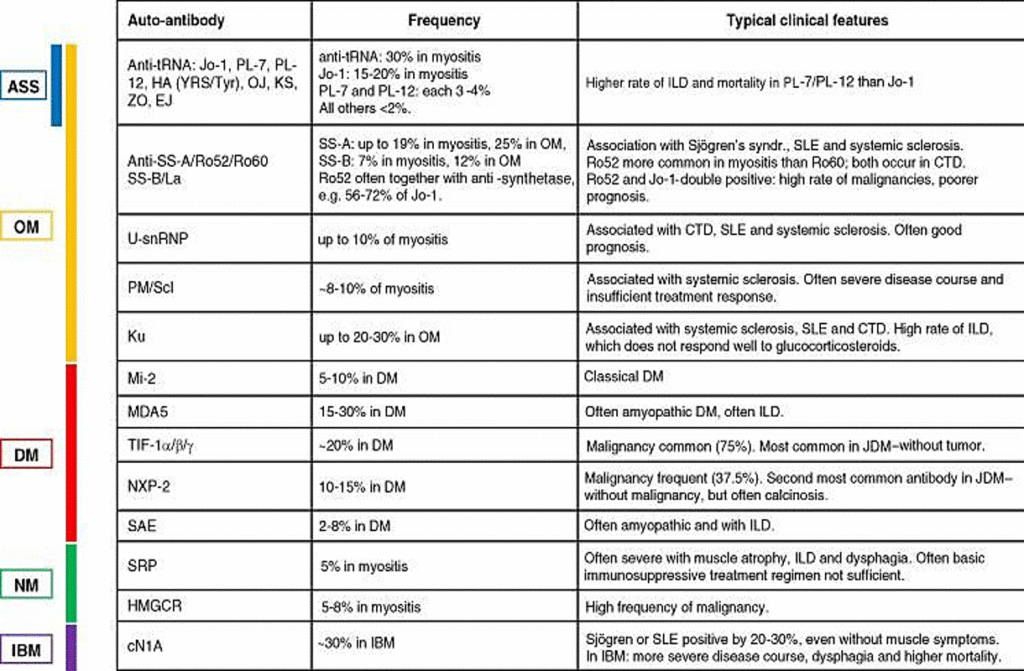
El auto-anticuerpo conocido más común y más largo asociado con la forma clásica de DM es el anticuerpo Mi-2, que se encuentra en hasta el 20% de los pacientes con DM.
Los anticuerpos MDA5 (término anterior: dermatomiositis antipilíndicamente miopática, CADM-140) se describieron por primera vez en 2009 y están presentes en 10–30% de los pacientes con DM, especialmente en casos con lesiones vasculíticas de la piel y una enfermedad grave inflamatoria grave con un aumento de la mortalidad. Un anticuerpo común en la DM con una frecuencia de aproximadamente un tercio de los casos es el anticuerpo anti-TIF-1 α / β / γ , que se describió por primera vez en 2006/2007.
Los anticuerpos TIF-1 están fuertemente asociados con tumores malignos en hasta un 75% de los pacientes adultos; en los niños, presentan uno de los anticuerpos más comunes y están asociados con la DMJ, pero no con los tumores en este grupo de edad.
Otro anticuerpo con una fuerte asociación de tumores es el anticuerpo NXP2 (inicialmente denominado anticuerpo MJ). Con una tasa de tumores reportada de hasta el 37.5%. NXP2 es también el segundo autoanticuerpo más común en niños con una frecuencia de hasta el 22% y puede tener un alto grado de calcinosis. Un anticuerpo identificado más recientemente que se asocia con aproximadamente el 8% de los casos de DM es SAE. Estos pacientes a menudo presentan un curso de enfermedad amopática y presentan disfagia y una EPI leve a moderada.
Los signos histopatológicos de la DM consisten en una inflamación perimisial, atrofia perifascicular y elevación perifascicular de MHC de clase 1, unión del complemento a los capilares y la superficie del sarcolema y reducción de los capilares. La característica patológica típica de la atrofia perifascicular es más común en la DMJ que en la DM. Un informe reciente demuestra que la tinción inmunohistoquímica para la proteína MxA es un marcador más sensible para la DM que otras características patológicas clásicas que incluyen atrofia perifascicular, lo que sugiere que es un marcador útil para el estudio histológico de la sospecha de miositis.
Polimiositis (PM)
La polimiositis (PM) es, con mucho, la forma más rara de miositis con una porción estimada de aproximadamente el 5% de todos los casos y algunos expertos incluso cuestionan su existencia. Una erupción u otros signos de inflamación de la piel no se producen en PM. El diagnóstico de PM se debe realizar mediante la exclusión de todos los demás tipos de miositis y, en los cursos crónicos de presunta PM, también se debe descartar una distrofia muscular (consulte la sección de criterios de diagnóstico a continuación).
Aunque varias bases de datos, informes y entradas de registro contienen «casos de PM» con la detección de uno de los anticuerpos contra la miositis que se muestran en la, en la actualidad es generalmente aceptado que ninguno de estos está realmente asociado con la enfermedad. Más bien, los pacientes sin erupción u otros signos patológicos de la piel y la distribución de la debilidad muscular como en «PM», con o sin signos de un síndrome de superposición (ver a continuación), podrían ser reclasificados como DM adermatomiopático o miositis por solapamiento (OM, ver más abajo).
Las características histopatológicas de la PM incluyen una “invasión” de las fibras musculares por la presencia de células T CD8 + citotóxicas endomisiales y la regulación al alza generalizada de MHC de clase I. Es importante destacar que la invasión de las fibras musculares por las
células T CD8 + citotóxicas no es única para la PM, sino que es aún más común en IBM y potencialmente presente en casos con DM o CULA. Deben estar ausentes los signos relevantes de acumulación de proteínas como en la miositis del cuerpo de inclusión o aumento del tejido conectivo como en la distrofia muscular.
Miopatía necrotizante (NM)
Miopatía necrotizante inmunomediada (IMNM; en resumen: miopatía necrotizante, NM; sinónimo: miopatía autoinmune necrotizante, NAM) conduce a una debilidad proximal aguda o subaguda de brazos y piernas. El curso de la enfermedad suele ser más rápido y grave en comparación con la DM y la PM. Las enzimas musculares suelen ser muy altas con una CK elevada de 20 a 50 veces. Las dificultades para tragar pueden ocurrir y la siguiente manifestación de órganos se resume a continuación.
Se ha demostrado que dos autoanticuerpos están asociados con el NM. Se esperan anticuerpos anti- SRP en aproximadamente 10 a 20% de los pacientes con NM, aunque la tasa de detección varía en gran medida (de 0% a 54%, resumido en). El anti-SRP puede asociarse con una cardiomiopatía y un curso de enfermedad grave con atrofia muscular, enfermedad pulmonar intersticial (EPI) y disfagia. El segundo auto-anticuerpo que se identificó en hasta el 60% de ciertas cohortes de NM es el anti-HMGCR. Un grado variable de 30 a 60% de estos pacientes tuvo una exposición previa a las estatinas. Se ha demostrado que una asociación con malignidad es mayor en pacientes con anti-HMGCR y sin autoanticuerpos en comparación con pacientes con anti-SRP.
El cuadro histológico en NM muestra miofibras necróticas dispersas de grado variable, regulación moderada y principalmente focal de MHC de clase I, particularmente en áreas con fibras necróticas, y unión del complemento al sarcolema. Algunas células T inflamatorias y otras células inmunitarias pueden estar presentes alrededor de estos puntos focales, pero no hay lesiones inflamatorias primarias. Las fibras necróticas típicamente muestran una invasión secundaria por los macrófagos para la eliminación de los desechos celulares. La unión del complemento está presente en los capilares y en la superficie de las fibras musculares. En la microscopía electrónica, pueden aparecer capilares de la tubería, pero no hay inclusiones tubureticulares en las células endoteliales (que están presentes en la DM).
Miositis superpuesta (OM)
La miositis superpuesta (OM; sinónimo: síndrome de superposición con miositis) se reconoce cada vez más como una forma individual de miositis que, a su vez, es heterogénea y presumiblemente abarca el
mayor subgrupo de miositis. El término OM ya se ha utilizado desde hace varios años y se basa en la identificación de autoanticuerpos asociados con la miositis (ver más abajo para más
detalles). Los pacientes con OM presentan un inicio agudo o subagudo de debilidad de brazos y piernas, similar a los tipos de miositis mencionados anteriormente. Una elevación profunda de las enzimas musculares, incluida la CK, suele estar presente (10 a 50 veces). La OM puede diagnosticarse junto con otros trastornos del colágeno, como el síndrome de Sjögren, la esclerosis sistémica o el lupus eritematoso sistémico (LES). La condición más común dentro de la OM es el síndrome anti-sintetasa (ASS), que puede considerarse una subforma distinta de la miositis. Consiste en una colección típica de síntomas clínicos que incluyen miositis, fenómeno de Raynaud, artritis, manos de mecánicos, enfermedad pulmonar intersticial (EPI) y presencia de autoanticuerpos antitransferencia de ARN sintetasa.
El más común de los ocho anticuerpos anti-sintetasa es el anticuerpo Jo-1, que se observa en alrededor del 30% de los pacientes con miositis según un reciente metanálisis. Anti-PL-7 y anti-PL-12 se encuentran en el 3-4% de los casos y todos los demás anticuerpos anti-sintetasa son menos comunes (<2%): anti-EJ, anti-ZO, anti-OJ, anti -K, anti-HA (YRS / Tyr). Dos grandes análisis de subgrupos revelaron una mayor tasa de ILD en pacientes con anti-PL-7 o anti-PL-12 en comparación con Jo-1 y esto fue acompañado por una mayor mortalidad. Aparte de los anticuerpos anti-sintetasa, otros cinco anticuerpos están asociados con la OM, así como con otros trastornos del tejido conectivo.
Pueden causar un síndrome clínico idéntico como ASS o algunas de las características, por ejemplo, ILD y miositis más los síntomas individuales del trastorno respectivo del tejido conectivo. El más común de estos anticuerpos es anti-PM / Scl (dirigido a dos subunidades de 75 kDa y 100 kDa de un complejo de exosoma nuclear), que se asocia comúnmente con esclerosis sistémica y se presenta en hasta el 12% de los casos de miositis. Los anticuerpos anti-U-snRNP se observan en 3 a 8% de los pacientes con miositis y se asocian con enfermedad mixta del tejido conectivo (CTD). Mientras que los pacientes con anti-U-snRNP a menudo tienen un buen pronóstico, anti-PM / Scl puede indicar un curso más grave y una respuesta al tratamiento insuficiente (revisado en).
Los anticuerpos anti-Ku están asociados con esclerosis sistémica, lupus eritemátodos sistémicos (LES) y otras CTC mixtas e indiferenciadas. En la miositis, en general son raras con una frecuencia de 1 a 3%, pero en los síndromes de superposición con miositis, están presentes en hasta el 19% de los casos. Tienen una alta tasa de ILD, que no responde bien a los glucocorticosteroides, mientras que los síntomas musculares suelen responder. Anti-SS-A /Ro52 / Ro60 y anti-SS-B /La suelen estar presentes en el síndrome de Sjögren, el LES y la esclerosis sistémica.
Ocurren en pacientes con miositis con una frecuencia del 19% y 7% respectivamente, y en OM están presentes en hasta el 25% y el 12% de los casos. Se ha demostrado que la SS-A está presente en el 6% de los pacientes con JDM. El subdominio anti-Ro52 es más común en pacientes con miositis que en Ro60, mientras que ambos están igualmente presentes en la CTD. El anti-Ro52 a menudo está presente junto con los anticuerpos anti-sintetasa, por ejemplo, en el 56–72% de los pacientes positivos para anti-Jo-1. Estos pacientes doble positivos tienen un mayor riesgo de malignidad y un peor pronóstico.
El cuadro histológico abarca una necrosis perifascicular y la unión perifascicular de los anticuerpos MHC de clase I y clase II, así como la unión del complemento a sarcolema en las mismas áreas del músculo esquelético.
Miositis del cuerpo de inclusión (IBM)
La presentación clínica de la miositis con cuerpos de inclusión es distinta de todas las otras formas de miositis: la elevación de la CK es mucho más leve (hasta 10-15 veces la regulación al alza), el inicio es mucho más asimétrico y puede comenzar con afecto unilateral de una pierna o brazo , por ejemplo, la pierna proximal, el antebrazo o la pantorrilla ventral; la progresión es mucho más lenta que la de otras formas de miositis, pero continúa sin descanso y conduce a una profunda atrofia muscular. El patrón típico de afectación muscular incluye debilidad de los flexores largos de los dedos, el cuadriceps, el tibial anterior y, generalmente, en menor medida, todos los demás músculos de los brazos y las piernas. Los problemas para tragar (disfagia) son comunes y pueden presentarse como el síntoma inicial. La debilidad a menudo conduce a caídas perjudiciales y la disfagia puede causar neumonía por
aspiración, lo que explica una mayor tasa de mortalidad en estos pacientes. La mayoría de los pacientes se ven afectados (2 a 3 veces) y la mayoría de los pacientes tienen más de 50 años de edad cuando los primeros síntomas evolucionan, aunque el diagnóstico puede hacerse mucho más tarde. Los cambios en la piel no están presentes.
El único anticuerpo asociado con IBM es cN1A (5NT1A / 5NTC1A, inicialmente denominado «Mup44»). Se identificó hace unos años y se pensó inicialmente que estaba presente en más de la mitad de los pacientes. Observaciones más recientes han demostrado que en la mayoría de las cohortes la frecuencia es de alrededor del 30% y rara vez es tan alta como 60% o más; Es importante destacar que, además de otras formas de miositis, como la DM, muchas otras afecciones, como el síndrome de Sjögren y el LES, también fueron positivas entre un 20 y un 30%, incluso en ausencia de síntomas musculares. Esto fue corroborado recientemente en una cohorte japonesa. Datos recientes en cohortes de IBM de tamaño razonable sugieren que la presencia de cN1A se asocia con un curso de enfermedad más grave y disfagia y una mayor mortalidad. Por el contrario, en un grupo de 20 pacientes alemanes, la presencia de cN1A no se correlacionó con la gravedad de la disfagia o el deterioro muscular.
El cuadro histológico abarca la «invasión» de las fibras musculares por las células T CD8 +citotóxicas endomisiales , una regulación generalizada y moderada a fuerte de MHC de clase I, signos de acumulación de proteínas por detección de amiloide (rojo Congo, tioflavina S, inmunohistoquímica para p62 o TDP -43), detección de tubulofilamentos en EM, vacuolas y signos de daño mitocondrial como lo demuestra la prueba histoquímica de fibras musculares deficientes en COX, e inclusiones de paracristalina. Sin embargo, los signos de acumulación de proteínas pueden estar ausentes, incluso la característica «canónica» de las vacuolas con borde puede faltar.
ASOCIACIÓN CON NEOPLASIAS Y MANIFESTACIONES EXTRAMUSCULARES
Se ha demostrado que todas las formas de miositis, excepto IBM, se asocian con frecuencias variables de neoplasias malignas con un riesgo aumentado de 2 a 7 veces en comparación con la población general. Como se indica en la sección sobre anticuerpos, este riesgo de malignidad es particularmente alto en casos de DM con anticuerpos anti-TIF-1 o anti-NXP2, así como en casos de NM con anticuerpos anti-HMGCR. Los pacientes sin presencia detectable de un autoanticuerpo también pueden sufrir cáncer, como se evidencia en casos con NM (ver arriba). El riesgo es mayor dentro de un año antes y después del diagnóstico de miositis y permanece elevado dentro de un período de tiempo de aproximadamente 3 años.
Los tipos de tumores malignos en la miositis incluyen cáncer de pulmón, mama y ovario, así como linfoma. Todos los pacientes con miositis recién diagnosticada deben recibir una tomografía computarizada (IRM) del tórax y el abdomen, y en ciertos casos con un alto nivel de sospecha, posiblemente una PET-TC y marcadores tumorales. Las pruebas adicionales, como la ecografía del abdomen y la gastroscopia o la colonoscopia o las derivaciones a especialistas, dependen de la situación individual de cada paciente. Según el resultado de la detección del tumor y el curso clínico de la miositis, la detección del tumor debe repetirse al menos una vez al año durante al menos tres años.
Una amplia gama de órganos extramusculares pueden verse afectados en la miositis: pulmón, corazón, articulaciones, piel, riñones y otros. La piel es un órgano comúnmente afectado en la miositis. La presentación clínica de la manifestación de la piel en la dermatomiositis con el signo de Gottron, la erupción con heliotropo de los párpados, el chal y el signo V se explicaron con más detalle anteriormente. Las manos de los mecánicos y el fenómeno de Raynaud se han mencionado en la sección ASS de arriba. Además, en la esclerosis sistémica, la piel de las manos y los pies muestra cicatrices, úlceras y engrosamiento. Los dedos de las manos y los pies pueden mostrar movilidad reducida (esclerodactilia) y la enfermedad puede progresar hacia áreas más proximales de brazos y piernas. La apertura de la boca se puede deteriorar (microstomía, “boca de la bolsa de tabaco”) y la cara puede aparecer como una máscara. La telangiectasia y el fenómeno de Raynaud son comunes. Los cambios en la piel que se producen en el LES incluyen la típica «erupción de la mariposa» (o erupción de
la malaria) y pueden presentarse como manchas rojas y escamosas de la piel, lo que se denomina erupción discoide. Una erupción típicamente se desarrolla en la piel expuesta al sol. Otras manifestaciones incluyen pérdida de cabello, telangiectasia y calcinosis. Los pacientes con sospecha de OM o detección de un auto-anticuerpo del grupo anti-sintetasa o anti-Pm / Scl, anti-SS-A / Ro, anti-SS-B
/ La deben someterse a una revisión para detectar cualquiera de los cambios cutáneos mencionados anteriormente.
La enfermedad pulmonar es una manifestación concomitante típica en la miositis y la frecuencia y la gravedad dependen del subtipo de miositis respectivo. Como se mencionó y destacó anteriormente, la ILD es común en ASS. El patrón de manifestaciones pulmonares incluye hipertensión pulmonar, serositis y diversos grados de EPI. La ventilación puede verse afectada adicionalmente por la inflamación y debilidad del diafragma y otros músculos requeridos para respirar. Los síntomas de la EPI incluyen disnea y tos, que pueden ser secas y no productivas. Además de todos los anticuerpos anti-sintetasa, la ILD en pacientes con miositis se asocia con anti-U-snRNP,
anti-PM / Scl, anti-Ku, anti-MDA5 y anti-SRP (ver las secciones respectivas de la enfermedad arriba y la. Aparte de la malignidad, la ILD es una de las manifestaciones orgánicas más críticas en la miositis y la ILD grave está claramente asociada con un aumento en la tasa de mortalidad en la miositis. Por lo tanto, se debe preguntar a los pacientes por síntomas de afectación pulmonar y se deben realizar pruebas de función pulmonar en todos los casos. Una tomografía computarizada (TC) del tórax (alta resolución) debe considerarse de manera rutinaria, dependiendo de la presencia de síntomas pulmonares, la gravedad general de la miositis, el tipo de autoanticuerpo y otras razones para las imágenes del tórax, como la detección de malignidad. Los hallazgos típicos de una ILD incluyen reticulación, opacidad lineal y de vidrio esmerilado, engrosamiento peribroncovascular, espacios quísticos con paredes engrosadas («panal de abeja») y bronquiectasias de tracción. La TC de tórax debe ser evaluada por un médico con experiencia en enfermedades con ILD y el manejo clínico de la ILD debe realizarse junto con un especialista pulmonar de forma multidisciplinaria.
La inflamación de las articulaciones es común en la enfermedad del tejido conectivo (TDC) y los síndromes de superposición con afectación de la piel, especialmente en el ASA. Los síntomas de la artritis incluyen hinchazón, dolor y rigidez de las articulaciones. Por lo general, las articulaciones de las manos pequeñas se ven afectadas, así como la muñeca, la cadera, la rodilla y el tobillo. El diagnóstico puede ser apoyado por cambios en los rayos X, como el estrechamiento del espacio articular y las erosiones óseas.
La participación del corazón no es infrecuente en la miositis y los síndromes de superposición, pero a menudo no se reconoce. El corazón puede verse afectado en forma de cardiomiopatía, serositis o pericarditis, así como problemas de conducción. La participación del corazón se asocia con un aumento de la mortalidad. Los síntomas típicos de compromiso cardíaco incluyen disnea, especialmente durante el ejercicio, y arritmia. Las pruebas deben incluir un ECG, potencialmente más de 24 horas para detectar arritmias, ecocardiografía y, si está disponible, IRM del corazón. Al identificar problemas cardíacos, se debe consultar a un especialista en cardiología para el tratamiento
interdisciplinario. Además del tratamiento sintomático para el corazón, en estos casos se debe considerar una inmunosupresión intensificada.
El tracto gastrointestinal y el hígado pueden verse afectados en síndromes de solapamiento y, en particular, alterar la función de la faringe y el esófago. Los síntomas varían desde una disfagia leve con tos ocasional durante la comida hasta un pasaje de alimentos severamente dañado con asfixia, etc., que posiblemente requiera una sonda nasogástrica o incluso una sonda percutánea. El peligro de problemas para tragar no reconocidos es el riesgo de aspiración con neumonía posterior o incluso la muerte. Los síntomas de la disfagia incluyen la limpieza repetida de la garganta durante la comida, la tos, la duración prolongada de la ingesta de alimentos, la sensación de que «los alimentos se atascan» y la asfixia. Es importante destacar que los pacientes pueden no informar sus síntomas sin preguntas específicas, por ejemplo, mediante el uso de cuestionarios específicos para la deglución, como el cuestionario Swal-Quol, Sydney Swallowing, etc. Además de la terapia del habla, los pacientes pueden recibir un tratamiento específico, como las inyecciones locales del tratamiento con toxina botulínica.
para IBM (consulte la sección sobre IBM a continuación para obtener detalles). Las pruebas de diagnóstico para la evaluación de la disfagia incluyen una evaluación endoscópica con fibra óptica de la deglución. Los pacientes con una anomalía en la deglución confirmada deben recibir una fluoroscopia, una evaluación basada en rayos X. En el futuro, la RM en tiempo real estará disponible para la evaluación general de la deglución.
Otras manifestaciones extramusculares son más raras en la miositis, como la afectación de los riñones , que se observa en aproximadamente el 60% de los pacientes con LES («nefritis por lupus») con signos típicos de disfunción renal, como edema de las piernas, proteinuria y hematuria. . Como un evento raro, la crisis renal tromboangiopática puede ocurrir en la esclerosis sistémica junto con el inicio o la aplicación de dosis altas de tratamiento con esteroides. Recientemente, este evento también se ha demostrado en un caso ASS con anticuerpo anti-PL7.
CRITERIOS DE CLASIFICACIÓN Y PARÁMETROS DE DIAGNÓSTICO
La mayoría de los expertos internacionales están de acuerdo en que el actual estándar de oro para un diagnóstico confiable de miositis requiere i) una evaluación clínica sólida que incluya el patrón de debilidad y parámetros paraclínicos como MRI y CK, ii) una evaluación amplia de autoanticuerpos, preferiblemente una ensayo de transferencia de líneas que cubre todos los autoanticuerpos disponibles actualmente en la miositis, iii) una biopsia muscular con un detallado estudio histológico e inmunohistológico que permite el subtipo de las diferentes entidades patológicas. Este concepto tradicional es válido a pesar de la reciente publicación de nuevos criterios para miositis que han sido aceptados formalmente por ACR y EULAR.
Estos criterios se han desarrollado utilizando un grupo de pacientes grande, pero no lo suficientemente bien caracterizado, de 976 pacientes con miositis. Se utilizan 12 parámetros clínicos y se transforman en un valor numérico: edad, sexo, patrón de debilidad, signos de manifestaciones en la piel, características de laboratorio que incluyen el anticuerpo Jo-1 y 4 parámetros de biopsia facultativos que incluyen patrón de inflamación, atrofia perifascicular y vacuolas. El puntaje numérico total para cada valor se usa luego para la clasificación en JDM, DM, ADM, IBM y PM, ya sea con o sin datos de biopsia, y cada uno como «definido», «probable» o «posible». Se ha configurado una calculadora web fácil de usar para este algoritmo: http://www.imm.ki.se/biostatistics/calculators/iim/.
La sensibilidad y especificidad de los nuevos criterios han sido comparadas con todos los criterios diagnósticos previos relevantes por Bohan & Peter, Tanimoto et al, Targoff et al, Dalakas y Hohlfeld, y ENMC Hoogendijk et al. Los nuevos criterios alcanzaron una sensibilidad general del 93% con biopsia y una especificidad del 88% con biopsia y ambos fueron considerablemente más bajos sin biopsia (87% de sensibilidad y 82% de especificidad). La sensibilidad con una biopsia fue comparable a los criterios de Bohan & Peter, Tanimoto y Targoff y fue mejor que los criterios de Dalakas & Hohlfeld, que fueron solo 6% sensibles y los criterios de Hoogendijk, que fueron 52% sensibles. La especificidad fue mejor que Bohan & Peter (55%) y Tanimoto (31%), comparable a Targoff (89%) e inferior a Dalakas & Hohlfeld (99%) y ENMC Hoogendijk (97%).
Los autores reconocen que sus nuevos criterios tienen limitaciones y esto se ve corroborado por las comunicaciones recientes a la publicación. El grupo de pacientes es grande, pero una parte significativa de ellos no se ha trabajado con suficiente detalle, como lo demuestra, por ejemplo, la falta de resultados de la biopsia, ii) Las entidades NM y OM no están representadas ya que estos diagnósticos fueron no lo suficientemente presente, y es muy probable que muchos pacientes dentro del registro de Euromiositis se diagnostiquen como PM o DM por error, pero que en realidad sufran de OM o NM, iii) en muchos pacientes no exista un perfil amplio de anticuerpos, por lo que la distinción de TIF 1, NXP-2, MDA-5, Mi-2, SRP, HMGCR, etc. no es posible. Los autores reconocen que existe la necesidad de validar los criterios diagnósticos recientemente publicados, que denominan «provisionales», y de revisarlos para incluir más autoanticuerpos, características de biopsias más específicas e inclusión de NM y OM como entidades separadas.
Ninguna de las clasificaciones de miositis mencionadas anteriormente incluye el panel de diagnóstico de autoanticuerpos «autoanticuerpos específicos de miositis» (MSA) y «anticuerpos asociados a miositis» (MAA). Esta distinción entre MSA y MAA se estableció hace varios años y, debido a los hallazgos recientes de miositis en casos de MAA y la presencia de MSA en casos sin miositis, la distinción arbitraria entre MSA y MAA parece estar obsoleta y actualmente es bastante obsoleta. Esto está en línea con la redacción de resúmenes recientes sobre autoanticuerpos de miositis por parte de otros.
Los criterios iniciales para IBM se han basado fuertemente en los criterios histológicos, mientras que los antiguos criterios ENMC y los de Dalakas, tienen características clínicas e histológicas igualmente ponderadas. Los criterios para IBM se han redefinido recientemente en un taller de ENMC con una sugerencia de los parámetros clínicos de que los pacientes deben tener más de 45 años, una CK de menos de 15 veces más elevada y características clínicas de flexores de los dedos más débiles que los abductores de hombro y / o cuádriceps más débiles que los flexores de cadera. Los parámetros histológicos incluyen signos de inflamación endomisial, así como vacuolas con borde y signos de acumulación de proteínas. Los parámetros se evaluaron en total y se produjeron como «IBM clínico-patológicamente definido», «IBM clínicamente definido» o «probable IBM». Una combinación de tres de los parámetros relevantes de los nuevos criterios de ENMC parece ser ideal para diagnosticar IBM con una sensibilidad del 90% y una especificidad del 96%, como lo demuestra una evaluación imparcial basada en computadora de 371 pacientes (200 IBM vs. 171 otras miopatías) ): (1) debilidad del flexor del dedo o debilidad del cuadriceps, y (2) inflamación endomisial, y (3) invasión de fibras musculares no necróticas o vacuolas con borde.
Además de los parámetros clínicos, que deben compararse con los que se resumen en la, los pacientes deben evaluarse mediante métodos paraclínicos. En particular, los parámetros de la RM, como la inflamación, la fibrosis y la atrofia, se pueden utilizar para determinar el patrón (subclínico) de la actividad de la enfermedad. La ecografía puede ayudar a distinguir un patrón de músculos afectados o al menos ayudar a identificar un músculo adecuado para la biopsia. Además de usar la MRI para el diagnóstico, es una herramienta adecuada para detectar daños agudos e inflamación actual. Una RM de cuerpo entero ahora se considera una técnica de vanguardia que ayuda a identificar la participación de los músculos incluso a un nivel subclínico. La RM también es útil para la detección de inflamación muscular en la miositis juvenil. En IBM, se puede usar la RM para identificar el patrón de los músculos afectados, que se ha demostrado que se correlaciona bien con otros parámetros clínicos y muestra una alta precisión diagnóstica y especificidad para la enfermedad. Los algoritmos de puntuación precisos y ampliamente aceptados ayudarán a mejorar el uso futuro de la MRI como un elemento de seguimiento clínico adicional y promover su uso en ensayos clínicos. Los cambios de EMG no son específicos y no ayudan a diferenciar los diferentes subformularios de miositis. Las descargas espontáneas observadas en la miositis aguda pueden incluso dar lugar a una sospecha errónea de enfermedad de la neurona motora. Una EMG puede ser útil para distinguir entre los cambios agudos en la miositis y la debilidad debido a la miopatía esteroide. Además del mero diagnóstico de miositis, se deben realizar evaluaciones paraclínicas para identificar afecciones subyacentes como una enfermedad maligna o una manifestación de un órgano como una enfermedad pulmonar intersticial (consulte las secciones de cada subgrupo para ver el diagnóstico respectivo).
Patomecanismos
Un resumen detallado de los mecanismos patológicos subyacentes de la miositis está más allá del alcance de esta revisión orientada clínicamente. Los mecanismos en la miositis se han revisado recientemente en otros lugares: mecanismos inflamatorios, mecanismos generales / mixtos, factores genéticos, mecanismos no inflamatorios, mioquinas, inmunidad innata, y mecanismos en IBM.
Los mecanismos inmunitarios celulares incluyen células T CD8 + citotóxicas que hacen contacto de célula a célula con las fibras musculares y ejercen sus gránulos citotóxicos con perforina y granzima B en la dirección de las fibras musculares. Varios informes han demostrado sistemáticamente que, en PM e IBM, estas células T se expanden clonalmente dentro del músculo y que los clones
individuales pueden rastrearse durante años mediante el perfilado de receptores de células T y la microdisección de captura con láser. Por otro lado, en PM e IBM, también se ha identificado una expansión clonal de células B, que apoya la relevancia patogénica de las células B en estos trastornos. Actualmente se cree que, mediante la secreción local de un rango de citoquinas proinflamatorias y quimiocinas, las fibras musculares pueden contribuir directamente al medio inflamatorio en el músculo con atracción y activación local de las células inmunitarias que posteriormente atacan. Las fibras musculares. Los mediadores del sistema inmunitario innato también se observan en la miositis y la expresión de los receptores tipo Toll está presente en el sarcolema de las fibras musculares.
Además de las vías inflamatorias, los mecanismos no inmunes también son operativos en el músculo de la miositis, incluido el estrés de ER, la activación de NF κ B y los radicales libres como el NO. Se supone que dichos mecanismos de estrés celular causan debilidad del músculo esquelético, incluso en ausencia de daño estructural causado por la lisis celular, la agregación de proteínas o una cascada de muerte celular. En IBM, varias líneas de evidencia sugieren que existe una interacción distinta entre los mecanismos inflamatorios, la transformación vacuolar y la acumulación de amiloide. La evidencia más reciente sugiere que los mediadores potenciales en esta red de eventos podrían ser HMGB1, su receptor RAGE, la producción de NO en la fibra de iNOS, o sobreexpresión de la proteína de choque térmico αB-crystallin.
El haplotipo HLA 8.1 se ha identificado como un factor de riesgo para la miositis en un análisis de todo el genoma de 1710 pacientes con miositis frente a 4724 controles. Esto se confirmó y exploró con más detalle mediante un análisis de polimorfismo de un solo nucleótido (SNP) a través de una evaluación de inmunochips de 2566 pacientes con miositis que identificaron varias variantes dentro del HLA 8.1 que se asociaron con ciertos subconjuntos de miositis, incluido IBM. Fuera de las moléculas de HLA, la asociación más fuerte se observó con el gen PTPN22 en PM, pero no en DM u otros subtipos.
La actividad autofágica se ha asociado con la acumulación de amiloide en IBM. Recientemente, se identificaron variantes en los genes de VCP, SQSTM1 y FYCO1 y se ha demostrado que este último es relevante para la actividad autofágica. Esto sugiere que una variación en la expresión de FYCO1 puede contribuir a la degeneración autofágica en el músculo IBM.
Se ha sugerido durante más de dos décadas que la miositis se asocia con factores ambientales. Datos recientes han demostrado que la exposición a la radiación UV, las infecciones y otros factores ambientales pueden tener un papel protector o desencadenante en la miositis. Se plantea la hipótesis de que los factores ambientales, en presencia o ausencia de condiciones genéticas subyacentes, pueden modular mecanismos inmunitarios que reducen los factores inhibidores o aumentan los efectos estimulantes y que esto activa o agrava una cascada autoinflamatoria.
CURSO DE ENFERMEDAD Y TRATAMIENTO
En general, la mayoría de los pacientes responde razonablemente bien al tratamiento inmunosupresor que se detalla a continuación. Sin embargo, es importante señalar que muchos pacientes continúan progresando a pesar de los intensos esfuerzos de tratamiento porque la inflamación muscular no se puede controlar suficientemente. Otra razón para la persistencia de la debilidad muscular es el inicio tardío del tratamiento, que puede provocar un daño muscular irreversible con fibrosis o reemplazo de grasa. Estos elementos del curso de la miositis explican la profunda carga de la enfermedad con una elevada morbilidad y mortalidad en todos los subformularios.
Los glucocorticosteroides son el pilar del tratamiento para PM, DM, NM y OM, mientras que IBM se trata de manera diferente y se revisará por separado a continuación. La racionalidad de los glucocorticosteroides se relaciona con varios ensayos antiguos no controlados y series de casos y está bien aceptada por todas las sociedades y subespecialidades médicas. Por lo general, la prednisolona se
administra por vía oral a una dosis de 0.5 a 1.0 mg / kg por día. Especialmente en casos agudos y graves, el tratamiento puede iniciarse con un pulso de dosis alta intravenosa de 250 a 1000 mg por día durante 3 a 5 días. El valor de CK no debe ser el único parámetro para la decisión de disminuir el uso de esteroides: los esteroides deben continuarse durante aproximadamente 4 a 12 semanas y se puede considerar una reducción una vez que se pueda documentar una mejoría clínica evidente por fuerza muscular (puntuación de la suma de MRC) o subjetiva / Escalas de evaluación objetiva (ver abajo). El estrechamiento debe realizarse lentamente 10 mg cada 1 o 2 semanas hasta alcanzar los 20 mg / día. La reducción gradual debe realizarse en pasos de 2.5 a 5.0 mg cada 1 o 2 semanas, dependiendo del curso de la enfermedad. Una dosis de mantenimiento de nis5 mg de prednisolona por día a menudo es necesaria, al menos durante una fase intermedia o incluso a largo plazo. El régimen de días alternos incluso se asoció con una mayor tasa de supervivencia a largo plazo en comparación con la aplicación diaria. Un tercer régimen de esteroides en la miositis es el tratamiento mensual del pulso oral con 4 días de 40 mg / día de dexametasona. Esta dosificación logró una eficacia similar y, al mismo tiempo, causó menos efectos secundarios. Los posibles efectos secundarios a largo plazo de los esteroides incluyen osteoporosis, cataratas, atrofia de la piel, diabetes mellitus, hipertensión, cambios de humor, aumento de peso y mayor riesgo de infecciones. Todos los pacientes que reciben tratamiento con esteroides a largo plazo (durante varios años) deben recibir 1000 mg / día de calcio y 500 UI de vitamina D. La inmunosupresión a largo plazo debe iniciarse en paralelo con el esteroide, a menos que solo haya un curso moderado de la enfermedad. Los inmunosupresores incluyen metotrexato (MTX), azatioprina (AZA) o micofenolato mofetilo (MMF). Un análisis Cochrane comparó todos los estudios clínicos disponibles con estos y otros agentes en la miositis y no pudo identificar ninguna eficacia significativa.
Sin embargo, dada la variedad de series de casos y la experiencia de los expertos, y en vista de la patogenia conocida de los trastornos, existe un consenso internacional para utilizar glucocorticosteroides e inmunosupresores para el tratamiento de la miositis de manera no convencional.
MTX se administra una vez a la semana en una dosis de 5 a 20 mg, seguido de 5 a 10 mg de ácido fólico al día siguiente. Se puede aplicar por vía oral o subcutánea; este último suele ser mejor tolerado en vista de los efectos secundarios gastrointestinales. Los efectos secundarios del MTX incluyen leucopenia, enzimas hepáticas elevadas, neumonitis intersticial y fibrosis pulmonar. Antes de usar AZA, es aconsejable evaluar la actividad enzimática de la tiopurinmetiltransferasa (TPMT). Si la actividad es normal, AZA puede iniciarse oralmente 50 mg / día durante la primera semana y luego aumentar cada semana hasta 200 mg / día y más, administrados una vez al día o divididos en tres dosis.
En pacientes con actividad reducida de TPMT, se debe usar una dosis inicial de 25 mg y se debe realizar un aumento de la dosis mucho más lento y cuidadoso. La dosis óptima se distingue por el recuento absoluto de linfocitos, que debe estar entre 600 y 1000 células por μl.
Los principales efectos secundarios potenciales de la AZA son leucopenia, malignidad, daño hepático y una variedad de síntomas gastrointestinales. La elección del inmunosupresor primario depende de la medicación conjunta, las enfermedades concomitantes y la experiencia personal con el medicamento por parte del médico.
Si tanto MTX como AZA no son bien tolerados, se puede usar MMF y generalmente se inicia a 500 mg dos veces al día. La dosis puede aumentarse a 2.0 o 2.5 g o incluso 3.0 g / día, divididos en tres dosis diarias. Incluso si el recuento de linfocitos puede reducirse rápidamente con todos los inmunosupresores, el efecto inmunosupresor biológico de AZA, MMF y MTX puede tomar varias semanas antes de que comience: MTX y MMF pueden tener un retraso de hasta 12 semanas y AZA puede tener un retraso de hasta 3 a 6 meses (o en raras ocasiones hasta un año) hasta que sea clínicamente efectivo. Un aumento de dosis de AZA,
Visión general de las modalidades de tratamiento básicas y escaladas en la miositis.
En caso de que el régimen estándar con esteroides y los inmunosupresores mencionados anteriormente no sea tolerado o no sea lo suficientemente efectivo, hay dos opciones disponibles: ciclosporina oral o inmunoglobulina intravenosa G (IVIG). La ciclosporina (ciclosporina A, CsA) (o su fármaco modificado tacrolimus) es un inmunosupresor eficaz que puede usarse como reemplazo o en combinación con otros fármacos inmunosupresores. Los efectos secundarios incluyen síntomas gastrointestinales, hipertensión, enfermedad renal y malignidad. La dosificación de CsA se debe realizar de acuerdo con los niveles plasmáticos terapéuticos, que se deben controlar con regularidad. Es de destacar que la mayoría de los inmunosupresores son potencialmente embriotóxicos o gonadotóxicos. En particular, MTX, MMF y ciclofosfamida deben evitarse durante el embarazo. AZA y CsA se consideran menos tóxicos y varios informes han demostrado un desarrollo normal del niño, pero si es posible, todavía parece recomendable evitar cualquier fármaco inmunosupresor varios meses antes de la concepción (¡tanto para mujeres como para hombres!) Y durante el embarazo.
La IVIG es otra alternativa o tratamiento complementario bien establecido para la miositis, que se ha demostrado eficaz en varios estudios clínicos y series de casos, en particular en DM y NM. La IVIG se aplica a 1-2 g / kg por ciclo de tratamiento cada 3 a 6 semanas (potencialmente cada 8 semanas), generalmente durante 1 a 2 o 3 días a una dosis diaria de 0.5–1.0 g / kg. La dosis individual para cada paciente debe establecerse a lo largo de varios ciclos de tratamiento. La dosis total depende del efecto clínico de la IgIV y la dosis diaria depende de cómo el paciente tolera el medicamento. Los efectos secundarios potenciales son reacciones alérgicas, dolor de cabeza, fiebre, trombosis y hemólisis. Muchos de los efectos están asociados con la dosis y la velocidad de infusión. Las reacciones alérgicas y la tolerabilidad general de la IgIV a menudo también dependen de la formulación específica y pueden eliminarse cambiando el proveedor. Se espera que el efecto terapéutico de la IgIV sea similar en todos los productos.
Si la inmunosupresión estándar y la IgIV no son suficientes, se debe considerar una escalada del tratamiento a rituximab (RTX) o ciclofosfamida (CYC). RTX se ha probado recientemente en un ensayo con 200 pacientes jóvenes y adultos con miositis. Aunque no se alcanzó el punto final primario, presumiblemente debido al diseño del estudio, la respuesta general a RTX generalmente se interpreta como exitosa ya que una parte importante de los pacientes mejoró claramente durante el ensayo.
Además del tratamiento farmacológico básico de DM, PM, NM y OM como se detalla anteriormente, se deben considerar varios puntos para subcategorías específicas: a) en todos los pacientes, una inicial y, según el tipo de miositis y autoinfección el estado del anticuerpo, también se debe realizar una detección repetida de la malignidad y se debe dar prioridad al tratamiento del tumor frente a la inmunosupresión; b) en NM , el régimen estándar a menudo no es suficiente para lograr la remisión, por lo que a menudo se requiere un tratamiento adicional con IVIG y / o un tratamiento de escalada con RTX, particularmente en pacientes con anticuerpos anti-SRP; c) afectación de la pielrequerirá protección contra la exposición a la luz solar / UV y tratamiento complementario con tratamiento tópico, por ejemplo con glucocorticosteroides; Se ha demostrado que la IgIV es eficaz con respecto a las lesiones cutáneas en la DM y, en particular en la DM juvenil, los fármacos contra la malaria (hidrocloroquina) pueden ser útiles; d) el manejo de la ILD debe realizarse de manera interdisciplinaria junto con un neumólogo y generalmente requiere un tratamiento más agresivo (descripción general en) con una combinación de glucocorticosteroides en dosis altas y un inmunosupresor como AZA más RTX o CYC; Las formas más leves pueden controlarse suficientemente mediante la adición de CsA; MTX debe usarse con precaución en pacientes con EPI, ya que puede inducir una neumonitis; La IVIG puede ser una opción temporal durante la infección o un tratamiento alternativo / complementario en pacientes con ILD y contraindicaciones para la terapia de intensificación inmunosupresora.
Además del tratamiento farmacológico, los pacientes con cualquier tipo de miositis deben recibir fisioterapia desde el comienzo de la enfermedad. Los informes históricos que sugieren evitar el ejercicio durante la fase aguda son obsoletos. La fisioterapia debe incluir todos los aspectos de la medicina de rehabilitación y el ejercicio de resistencia no fatigante como terapia a largo plazo de todos los pacientes hasta que los síntomas clínicos se hayan resuelto por completo.
TRATAMIENTO DE IBM
Actualmente no hay un tratamiento efectivo disponible para IBM. En particular, el régimen inmunosupresor estándar con glucocorticosteroides e inmunosupresores no conduce a una mejora de la fuerza muscular deteriorada como lo demuestran varios ensayos clínicos con glucocorticosteroides, MTX, CsA, etc. (revisado en). Por lo tanto, el tratamiento con glucocorticosteroides o inmunosupresores generalmente no se recomienda en IBM. Alemtuzumab condujo a una mejoría transitoria en algunos pacientes dentro de un estudio de prueba de concepto no cegado. En un análisis post-hoc , se observó una disminución de la modulación de los marcadores inflamatorios, pero las moléculas degenerativas se mantuvieron sin cambios. Sin embargo, debido a la naturaleza incontrolada y al pequeño tamaño del estudio, los resultados deben interpretarse con cuidado y no son suficientes para justificar un tratamiento con alemtuzumab en IBM; se justificaría un ensayo clínico para estudiar el efecto. Tres ensayos clínicos controlados con placebo evaluaron la IgIV en IBM durante 3 a 6 meses: dos de los estudios observaron un pequeño aumento de algunos de los resultados, incluida la escala MRC y la función de deglución (resumen en). La IgIV se evaluó más a fondo en varias series de casos no controlados, que mostraron una mejoría de la disfagia y la debilidad muscular. Sin embargo, todos los ensayos clínicos de IVIG perdieron su resultado primario, lo que probablemente se explica por una duración insuficiente de los estudios (3 meses en 2 estudios y 6 meses en 1 estudio), por lo que no se puede obtener una conclusión confiable para el uso de IVIG en IBM hecho. En vista de la serie de casos positivos en esta enfermedad devastadora que a menudo se asocia con disfagia severa, neumonía por aspiración y un aumento de la mortalidad, un tratamiento probatorio con IVIG durante 6 meses con una dosis de 1-2 g / kg cada 6– 8 semanas parece ser justificable en tales pacientes, sin embargo, su uso puede estar restringido por las políticas nacionales de reembolso. Un grupo internacional de expertos establece actualmente el estándar de atención para IBM, incluidos todos los tratamientos farmacológicos y no farmacológicos.
Aproximadamente 2/3 de los pacientes sufren diversos grados de dificultad para tragar , a veces incluso como el único síntoma. La causa de la deglución es una estenosis funcional del esfínter esofágico superior, que puede detectarse mediante videofluoroscopia o MRI en tiempo real (esta última en un contexto de investigación). Las posibilidades de tratamiento local incluyen la miotomía cricofaríngea, la dilatación del balón faringoesofágico y las inyecciones repetidas de toxina botulínica en el esfínter esofágico superior. Dado que los datos recientes sugieren una excursión laríngea alterada como causa de disfagia en IBM, no se debe esperar un efecto beneficioso de la dilatación con balón y nuestra propia interpretación es que la dilatación puede incluso causar daño muscular adicional en la faringe / esófago. La miotomía cricofaríngea es una técnica efectiva, pero es irreversible y los pacientes pueden sufrir de reflujo u otros problemas para tragar. Se ha demostrado que las inyecciones locales de toxina botulínica son eficaces en IBM en varias series de casos y nuestra propia experiencia también respalda este tratamiento (observaciones no publicadas). Una vez que la disfagia ha evolucionado, es probable que persista y empeore. La detección regular de la aspiración, que incluye una evaluación endoscópica con fibra óptica de la deglución (FEES), es aconsejable para identificar la disfagia y prevenir la neumonía por aspiración o incluso el riesgo de muerte, que es más común en pacientes con insuficiencia cardíaca aguda con insuficiencia cardíaca aguda. El control del peso debe realizarse para evitar la caquexia y, si fallan otras opciones de tratamiento, debe considerarse una sonda de alimentación percutánea para evitar la aspiración y asegurar un suministro de calorías suficiente.
EVALUACIÓN DEL CURSO DE ENFERMEDADES Y RESEÑA DE LOS ENSAYOS CLÍNICOS PERTINENTES
Tanto en la práctica clínica como en los estudios clínicos, se requieren escalas clínicas que permitan una comparación rápida y confiable de dos visitas del paciente (ver para una descripción general reciente). Esto es indispensable para una evaluación consistente del tratamiento y las decisiones de escalada de dosis, incluido el cambio a un medicamento más agresivo. El Grupo Internacional de Evaluación de Miositis y Estudios Clínicos (IMACS) ha desarrollado herramientas de evaluación altamente relevantes que proporcionan medidas clínicas apropiadas: seis elementos se incluyeron en el conjunto principal de actividad de la enfermedad, incluida la evaluación de la actividad global de médicos y pacientes, la fuerza muscular (pruebas musculares manuales ), discapacidad funcional, enzimas musculares y actividad de la enfermedad extramuscular. La actividad de la enfermedad muscular adicional es un componente importante del conjunto del núcleo, ya que refleja el daño tisular de las articulaciones, los pulmones, la piel, el corazón o el sistema gastrointestinal.
Recientemente, las medidas del conjunto principal se transformaron en una escala numérica y se ponderaron en función de su impacto en la puntuación final; este puntaje compuesto fue oficialmente acreditado como «criterios de respuesta» por el Colegio Americano de Reumatología (ACR) y la Liga Europea contra la Reumatología (EULAR) para miositis de adultos, así como para miositis juvenil.
La prueba muscular manual de un grupo de músculos (MMT-6 o MMT-8) es un componente importante de esta evaluación longitudinal en la miositis y debe ser realizada por el médico en cada visita clínica. Para capturar el componente de resistencia además de la fuerza máxima corta, el índice funcional y su segunda versión se han desarrollado para miositis y se ha demostrado que una prueba de caminata de 2 minutos es una medida confiable en pacientes con IBM.
Las medidas de resultados informados por los pacientes (PRO), como el cuestionario de evaluación de la salud (HAQ), son un componente esencial de la observación a largo plazo de los pacientes con miositis. Es importante tener en cuenta el grado de dolor, fatiga y el prurito severo, a menudo casi ubicuo, como en la DM y la afección morfológica de la piel, esto último mediante el uso del Índice de Severidad y Área de Enfermedad de la Dermatomiositis Cutánea (CDASI).
Se han desarrollado dos PRO muy similares, útiles y fuertemente correlacionados para IBM: la escala de calificación funcional de miositis de cuerpos de inclusión (IBM-FRS) [y la evaluación física funcional de miositis de cuerpos de inclusión esporádicos (sIFA). Otra herramienta desarrollada específicamente para capturar aspectos funcionales y de resistencia en pacientes con miopatía, incluida la miositis, es la herramienta de evaluación de la miopatía en adultos (AMAT). En un esfuerzo internacional, los PRO para la miositis se evalúan actualmente con el objetivo de hacerlos más precisos y confiables. Especialmente en pacientes con disfagia, es importante incluir también una escala que capture los síntomas de la deglución, por ejemplo, el Cuestionario de Sydney para la deglución (SSQ).
En cuanto al número de ensayos clínicos importantes en las últimas décadas, las miopatías inflamatorias (y los trastornos neuromusculares en general) se han descuidado en comparación con otras áreas de la enfermedad. Esto ha cambiado enormemente en los últimos años y se espera que los trastornos neuromusculares se mantengan en el foco de interés para los próximos años. Varios ensayos clínicos en DM y / o PM se han realizado recientemente o están actualmente en curso.
La clasificación ideal que se puede usar como un criterio de inclusión fácil y confiable para los ensayos clínicos todavía no existe. Los criterios de clasificación recientemente publicados tienen problemas inherentes como se discutió anteriormente y, por lo tanto, no parecen ser útiles sin elementos de diagnóstico adicionales como el estado del anticuerpo. Está fuera del alcance de esta revisión analizar todos los ensayos recientes y solo se puede discutir aquí una pequeña selección: Belimumab es un inhibidor del factor de activación de células B (BAFF) y se estudia para el mantenimiento de la DM / PM en un ensayo de fase 2/3 controlado con placebo. Un ensayo de fase 2 controlado con placebo con tocilizumab, un bloqueador del receptor de IL-6, está en curso.
En 2017 se inició un ensayo de fase 3 controlado con placebo en todos los subformularios de miositis con Abatacept, una proteína de fusión CTLA-4 que actúa como inhibidor de la coestimulación para las células T. En 2017 se inició un ensayo de fase 3 controlado con placebo en DM con IVIG Octagam 10%. Basiliximab, un nuevo inhibidor de la calcineurina, se estudia actualmente como un fármaco adicional en un ensayo abierto de fase 2 en pacientes con ILD en ADM. IFN-Kinoid es un fármaco inmunizante que induce la generación de anticuerpos anti- IFN- α neutralizantes y actualmente se estudia en un estudio de fase 2 controlado con un solo placebo en DM. Los ensayos clínicos en DM y PM con BAF321, un modulador del receptor de esfingosina 1-fosfato (S1P) que inhibe la migración de linfocitos de los ganglios linfáticos, han finalizado. Los bloqueadores del TNF- αdeberían evitarse en la miositis, ya que se ha descrito un empeoramiento.
Un estudio reciente de fase 2b / 3 con bimagrumab, un anticuerpo monoclonal que actúa a través de la inducción del crecimiento muscular mediada por miostatina, falló su prueba de caminata primaria de 6 minutos, pero aún no se han publicado todos los datos. En un estudio de prueba de concepto doble ciego recientemente completado (fase 2b), 44 pacientes con IBM fueron tratados con 2 mg / día de rapamicina versus placebo durante un año.
Aunque no se mejoró la fuerza del cuadriceps como medida de resultado primaria, varios parámetros clínicos, incluida la prueba de caminata de 6 minutos y un índice compuesto funcional mostraron un efecto positivo significativo en el tratamiento.
Este es el primer estudio clínico en IBM con una duración suficiente que muestra una mejora significativa y clínicamente significativa, que apoya la realización de un ensayo más amplio con rapamicina en el futuro.
Otro estudio de concepto reciente se llevó a cabo con arimoclomol, que fue eficaz en el modelo de ratón con proteína que contiene valosina (PCV), cultivos de células musculares y fue bien tolerado en un ensayo pequeño, doble ciego, controlado con placebo, de fase 2 en IBM durante 4 meses con 8 meses adicionales de evaluaciones clínicas.
Recientemente se inició un gran ensayo doble ciego controlado por placebo en 150 pacientes con IBM que recibirán 400 mg de arimoclomol tres veces al día durante un año. Más estudios clínicos recientes y posibles objetivos farmacológicos para futuros esfuerzos han sido revisados por nosotros antes.
CONCLUSIONES
Las miopatías inflamatorias son trastornos heterogéneos que, aparte de una inflamación del músculo a menudo grave y aguda, pueden afectar a varios órganos extramusculares. Los principales subtipos de miositis incluyen DM, PM, NM, IBM, OM y ASS. La clasificación y el manejo de los diferentes subformularios generalmente requieren la atención de un equipo multidisciplinario que incluye experiencia de varias especialidades: reumatología, neurología, dermatología, neuropatología, neumología y otras. El diagnóstico se basa en una evaluación combinada de i) los síntomas clínicos y el curso de la enfermedad, incluida la resonancia magnética muscular y la detección de la manifestación de órganos extramusculares como la EPI, ii) una detección completa de autoanticuerpos asociados con miositis, incluidos los anticuerpos anti-sintetasa, Mi-2, Jo-1, TIF-1, NXP-2, SRP, HMGCR, cN1A y otros, iii) un detallado estudio histopatológico de una biopsia muscular que incluye subtipos inmunohistoquímicos de las células inmunitarias y tinción para el complemento y MHC de clase 1 y 2. El tratamiento básico de todas las subformas de miositis, excepto IBM, incluye glucocorticosteroides durante varias semanas a meses (y posiblemente más) y A menudo una inmunosupresión por AZA o MTX. El tratamiento complementario o la terapia de escalada pueden incluir IVIG, CYC y RTX. En IBM, un tratamiento probatorio con IVIG puede ser justificable en pacientes seleccionados. Todos los pacientes con miositis deben recibir fisioterapia a largo plazo y rehabilitación regular. Todos los tratamientos deben ser monitoreados de cerca usando escalas adecuadas que describan el estado actual del paciente. La modificación del régimen de tratamiento debe tener en cuenta el curso general de la enfermedad, así como las manifestaciones extramusculares. Las mejoras futuras deben apuntar a avanzar en el esquema de escalamiento terapéutico y continuar explorando el uso de tratamientos dirigidos, incluido el uso de productos biológicos como en varios ensayos clínicos en curso. Es necesario mejorar los criterios de diagnóstico que incorporan datos clínicos, histológicos y de autoanticuerpos para proporcionar un diagnóstico confiable y permitir un tratamiento eficaz en todas las subformas de miositis.
Abreviaturas:
IIM: Miopatia idiopática inflamatória
DM: Dermatomiositis
IBM: Miositis por cuerpos de inclusión
JDM: Dermatomiositis juvenil
ADM: DM amiopática
PM: Polimiositis
OM: Miositis superpuesta
NM: Miopatia necrotizante
MSA: Autoanticuerpos específicos de Miositis
MAA: Anticuerpos asociados a Miositis
ILD: Enfermedad pulmonar intersticial
Enlace interno
Reumatología. Medical & Gabeents
Enlace externo






[…] Esto incluye neuropatía motora multifocal, radiculomielopatía cervical, fasciculaciones benignas, miopatías inflamatorias, síndrome post-polio, amiotrofia monomélica, paraplejia espástica hereditaria, atrofia muscular […]