Introducción
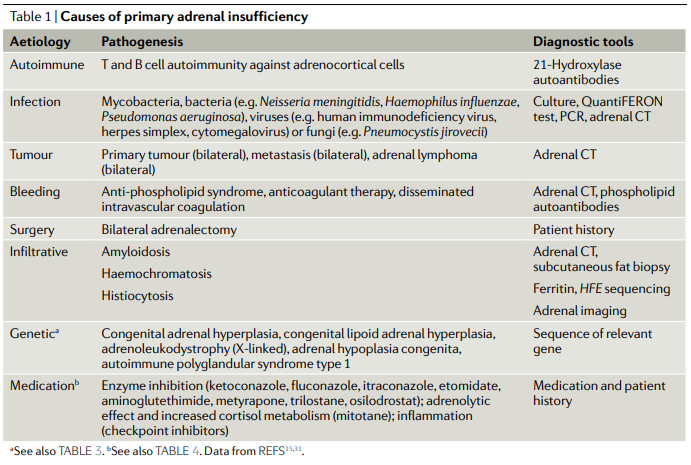
Autoinmune (atrofia suprarrenal idiopática) la más frecuente. Se destruye selectivamente la corteza adrenal, posiblemente por linfocitos T citotóxicos, afectándose sus 3 capas (primero la glomerular al principio aparece aumento de la actividad de renina plasmática con niveles de aldosterona normales o bajos–, luego la fascicular y luego la reticular). La clínica aparece cuando se destruye > 90% de la glándula.
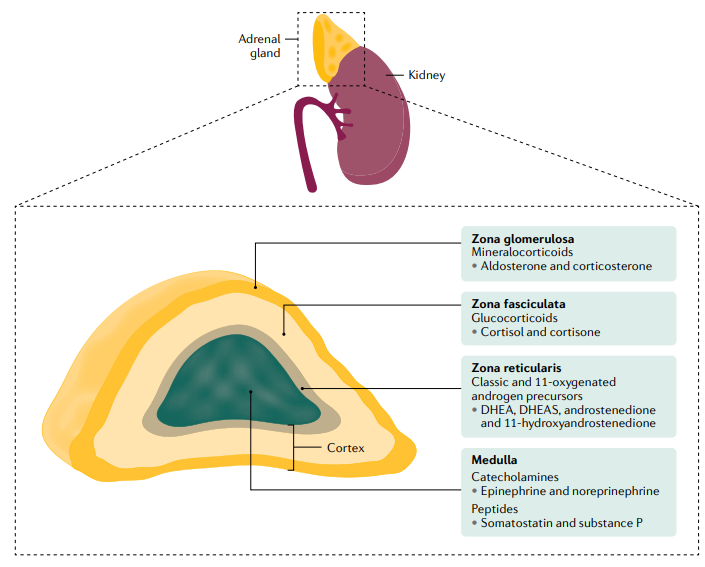
DHEA, dehidroepiandrosterona; DHEAS, sulfato de dehidroepiandrosterona.
Puede asociarse a otras enfermedades autoinmunes (DM tipo 1, vitíligo, enfermedad tiroidea autoinmune…), y a veces forma parte de un síndrome poli glandular autoinmune (SPA).
Un 50-70% de pacientes presentan anticuerpos contra enzimas de la esteroidogénesis suprarrenal (21-hidroxilasa).
Tuberculosa: se destruyen tanto corteza como médula, la más frecuente antiguamente. En la adrenalitis tuberculosa, la suprarrenal está hipertrofiada inicialmente, después se produce fibrosis quedando de tamaño normal o atrófica, con presencia de calcificaciones en el 50% de los casos.
Causas infrecuentes: hemorragia bilateral (por sepsis meningocócica o síndrome de Waterhouse-Friderichsen, coagulopatías o terapia anticoagulante), infarto bilateral, infecciones por hongos o virus (CMV, VIH…), infiltración (metástasis, amiloidosis, sarcoidosis, hemocromatosis), suprarrenalectomía quirúrgica, fármacos (mitotane, metirapona, ketoconazol, aminoglutetimida).
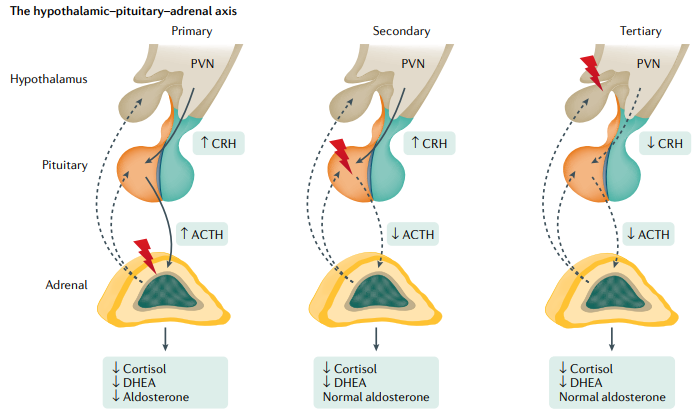
La CRH a su vez estimula la liberación de la hormona adrenocorticotrópica (ACTH) a la circulación, que induce la secreción de corticosteroides, principalmente cortisol pero también dehidroepiandrosterona (DHEA) y, en menor medida, aldosterona.
El eje hipotalámico-pituitario-suprarrenal está regulado por el cortisol mediante la regulación por retroalimentación tanto en el hipotálamo como en la hipófisis.
En la insuficiencia suprarrenal primaria, la deficiencia de glucocorticoides conduce a una pérdida de la retroalimentación negativa del cortisol en el hipotálamo y la hipófisis, lo que produce un aumento de los niveles de CRH y ACTH. Además, la disminución de la secreción de aldosterona da como resultado una mayor liberación de renina del riñón.
En la insuficiencia suprarrenal secundaria (SAI), la síntesis y secreción de ACTH están alteradas, lo que lleva a una pérdida de la producción de cortisol suprarrenal y DHEA; sin embargo, la producción de aldosterona no se ve afectada ya que la cascada de señalización del sistema renina-angiotensina-aldosterona no se ve afectada.
La insuficiencia suprarrenal terciaria (TAI) puede ser causada por factores endógenos que afectan directamente a la región hipotalámica o después del tratamiento del síndrome de Cushing endógeno. Con mayor frecuencia, la administración exógena de farmacoterapia con glucocorticoides produce TAI. La secreción de CRH hipotalámica disminuida en TAI da como resultado una estimulación reducida de ACTH; Al igual que el SAI, la secreción de cortisol y DHEA está alterada, aunque se conserva la secreción de aldosterona. Es de destacar que a menudo la diferenciación entre SAI y TAI es difícil, o pueden ocurrir formas mixtas de SAI y TAI (por ejemplo, por medicamentos). Como los cambios resultantes en las hormonas adrenocorticales periféricas son comparables, el término «IA secundaria» se utiliza con frecuencia para ambas formas.
Secundaria
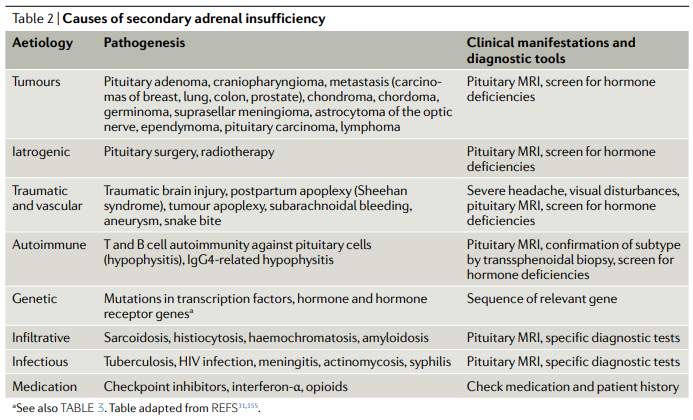
Por patología hipotalamohipofisaria, con déficit de ACTH o supresión del eje por administración exógena de glucocorticoides. En estos casos se afectan sólo las capas fascicular (producción de glucocorticoides) y reticular (producción de andrógenos), manteniéndose intacta la secreción de mineralocorticoides
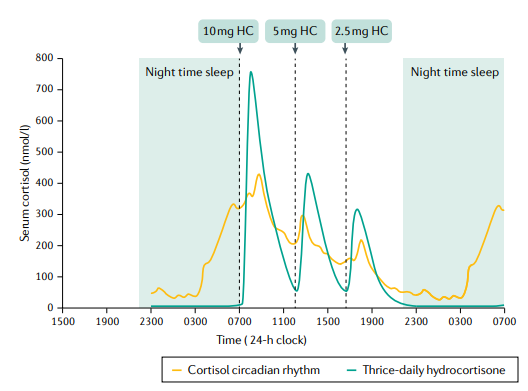
terapia con hidrocortisona. Ritmo circadiano de cortisol que muestra un pico temprano en la mañana y pulsos a la hora de las comidas superpuestos con el perfil de cortisol de la terapia de reemplazo de hidrocortisona (HC) tres veces al día. Las líneas discontinuas indican la ingesta oral de hidrocortisona convencional en dosis de 10 mg por la mañana, 5 mg al mediodía y 2,5 mg por la tarde.
Manifestaciones clínicas
La presentación clínica de la insuficiencia suprarrenal es variable, dependiendo de si el inicio es agudo, que conduce a una crisis suprarrenal, o crónico, con síntomas que son más insidiosos y vagos. Por lo tanto, el diagnóstico de insuficiencia suprarrenal depende de tener un nivel adecuado de sospecha clínica. La crisis suprarrenal debe considerarse en cualquier paciente que presente colapso vascular periférico (shock vasodilatador), independientemente de si se sabe o no que el paciente tiene insuficiencia suprarrenal. Del mismo modo, la deficiencia aislada de corticotropina (ACTH), aunque rara, debe considerarse en cualquier paciente que tenga hipoglucemia o hiponatremia grave inexplicable.
Astenia, anorexia, pérdida de peso, náuseas y vómitos, dolor abdominal, tendencia a la hipotensión, disminución de vello axilar y púbico en la mujer (por déficit de andrógenos suprarrenales), disminución de los requerimientos de insulina en pacientes diabéticos.
La administración prolongada de dosis farmacológicas de glucocorticoides sintéticos es, con mucho, la causa más común de deficiencia de ACTH y la consiguiente insuficiencia suprarrenal.
Hiperpigmentación de piel y mucosas (especialmente en zonas descubiertas, pliegues, aréolas, cicatrices y zonas sometidas a roce o presión).
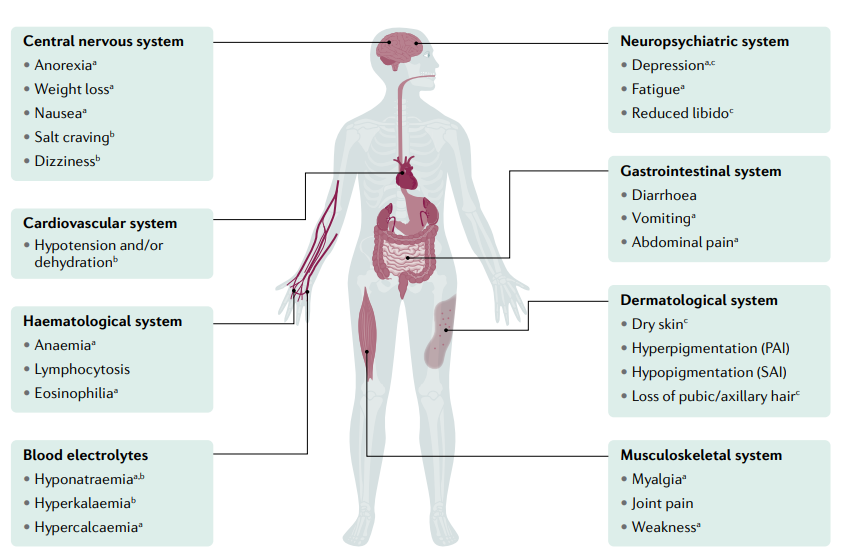
La deficiencia de hormonas adrenocorticales afecta a todos los sistemas del cuerpo humano y produce una amplia gama de síntomas. Se demuestran los síntomas frecuentes y sus principales asociaciones con la deficiencia respectiva de glucocorticoides, mineralocorticoides y andrógenos suprarrenales. PAI, insuficiencia suprarrenal primaria; SAI, insuficiencia suprarrenal secundaria. a
Síntomas específicos de la deficiencia de glucocorticoides; b Síntomas específicos de la deficiencia de mineralocorticoides; c Síntomas específicos de la deficiencia de andrógenos suprarrenales.
Evaluación
Al evaluar al paciente con posible insuficiencia suprarrenal:
Para la mayoría de los pacientes, medir el cortisol sérico de 8 AM y la ACTH plasmática, y una prueba de estimulación de ACTH en dosis altas de 250 mcg.
Si se sospecha una deficiencia de ACTH de inicio nuevo o reciente (por ejemplo, cirugía hipofisaria en las últimas dos semanas), realizar la prueba de estimulación de ACTH dosis baja de 1 mcg.
Si se confirma la insuficiencia suprarrenal y los niveles de ACTH son normales o altos (es decir, la insuficiencia suprarrenal primaria es el diagnóstico), se debe realizar una evaluación adicional de la deficiencia de mineralocorticoides (actividad plasmática de renina [PRA] o concentración de renina y aldosterona sérica).
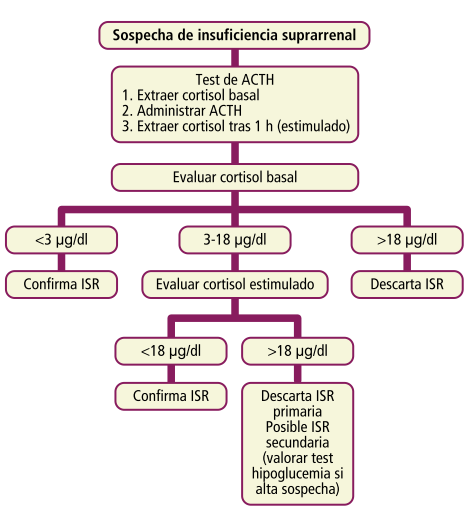
La prueba diagnóstica de elección en la insuficiencia suprarrenal (ISR) primaria es la prueba de estimulación con ACTH. Incluye una determinación de cortisol basal (<3 μg/dl confirma ISR, >18 μg/dl descarta ISR), y una determinación de cortisol estimulada. Si el cortisol basal es indeterminado (entre 3 y 18 μg/dl) se evalúa el estimulado: el cortisol debe ser >18 μg/dl en una suprarrenal sana (si tras la estimulación es <18 μg/ dl indica ISR primaria).
Niveles de ACTH: para diferenciar entre ISR primaria (ACTH elevada) y secundaria (ACTH normal o baja).
Test de hipoglucemia insulínica: se realiza en caso de alta sospecha de ISR secundaria con valores estimulados normales (aunque la hipófisis no sintetice ACTH, la suprarrenal puede conservar respuesta a ACTH exógena y ser normal el valor de cortisol tras estimulación hasta que aparece atrofia de la capa fasciculorreticular posteriormente, alrededor de 6 semanas tras el cese de síntesis de ACTH).
TRATAMIENTO
Glucocorticoides: hidrocortisona 20 mg/día, repartidos en 3 dosis (administrar la mayor parte de la dosis por la mañana para simular el ritmo circadiano del cortisol) o dexametasona 0,5 mg nocturnos. Se debe doblar la dosis en situaciones de estrés, infección o cirugía, y administrar de forma parenteral en caso de vómitos. Los pacientes deben llevar un brazalete identificativo.
Está disponible una nueva formulación de hidrocortisona de liberación prolongada en toma única diaria. Se asemeja más al ritmo fisiológico del cortisol, produce menos ganancia ponderal y menor alteraciones del metabolismo hidrocarbonado, y mejora la calidad de vida en pacientes mal controlados con la formulación clásica.
Mineralocorticoides: fludrocortisona. Sólo necesarios en la insuficiencia suprarrenal primaria. El mejor parámetro de control de la dosis de fludrocortisona es la actividad de renina plasmática.
Crisis adrenal.
Retirada brusca de los corticoides en pacientes con insuficiencia suprarrenal secundaria por administración crónica de los mismos. Otras causas: situaciones de estrés agudo en pacientes con insuficiencia suprarrenal primaria, o destrucción súbita de las suprarrenales en un paciente previamente sano (hemorragia bilateral).
Se caracteriza por astenia intensa, náuseas, vómitos, diarrea y dolores abdominales, intensa deshidratación e hipotensión que pueden desencadenar shock, coma y muerte.
Es urgente, con hidrocortisona intravenosa a altas dosis y reposición de agua y sodio con una solución salina fisiológica intravenosa. Como cursa con tendencia a la hipoglucemia, debemos asociar sueros glucosados para prevenirla o tratarla. Es muy importante buscar la causa.
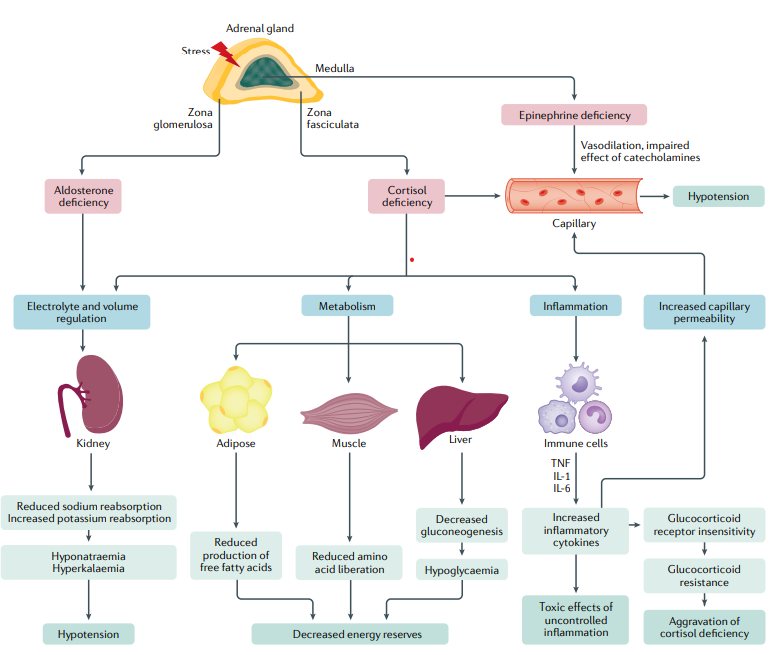
Un desequilibrio entre la demanda y la disponibilidad de glucocorticoides puede provocar una crisis suprarrenal. Este estado se caracteriza por una respuesta inmune modificada debido a la falta de inmunomodulación mediada por glucocorticoides, lo que conduce a un aumento de las citocinas inflamatorias que activan aún más las vías proinflamatorias. La deficiencia de cortisol se ve agravada por una resistencia al receptor de glucocorticoides inducida por citocinas. Además, la deficiencia de cortisol conduce a una capacidad de respuesta reducida a las catecolaminas en los vasos sanguíneos, lo que agrava los efectos de la depleción de volumen causada por la deficiencia de aldosterona en la insuficiencia suprarrenal primaria. La deficiencia de cortisol además da como resultado una movilización deficiente de los recursos energéticos debido a la reducción de la gluconeogénesis hepática, la reducción de la liberación de aminoácidos musculares y la reducción de la producción de ácidos grasos.




