El esófago de Barrett se define como una enfermedad secundaria a un daño de la mucosa esofágica que produce una transformación del epitelio escamoso del esófago a un epitelio columnar intestinal (Metaplasia).
Se reconoce mediante endoscopia, pero la confirmación se establece por histopatología. La metaplasia intestinal del esófago es una lesión premaligna que predispone al adenocarcinoma de esófago y de la unión esofagogástrica (Cáncer de esófago). La gran mayoría de los adenocarcinomas del esófago se acompaña de metaplasia intestinal.
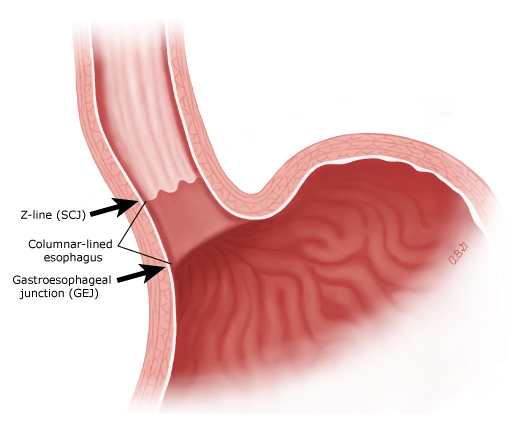
La unión escamocolumnar (SCJ o línea Z) es la línea visible formada por la yuxtaposición de epitelios escamosos y columnares. La unión gastroesofágica (GEJ) es la línea imaginaria en la que termina el esófago y comienza el estómago. El GEJ corresponde a la extensión más proximal de los pliegues gástricos. Cuando la SCJ se encuentra proximal a la GEJ, hay un segmento columnar de esófago.
Etiología
El origen del esófago de Barrett es el reflujo gastroesofágico grave, con síntomas de más de 10 años de duración. Otras causas de esófago de Barrett son exposición mayor a ácido en comparación con pacientes con ERGE sin Barrett, con presencia de hernia hiatal grande, hipotensión del esfínter esofágico inferior, motilidad esofágica pobre y reflujo biliar.
No se relaciona con mayor secreción de ácido basal ni estimulada por gastrina, ayuno o concentraciones altas de pepsina. En fecha reciente se ha relacionado con la obesidad.
El desarrollo del esófago de Barrett requiere lesión de la mucosa esofágica acompañada de una alteración de los mecanismos de reparación epitelial. Hasta la fecha se desconoce el mecanismo por el cual se origina metaplasia y por qué ocurre en algunos individuos y no en otros.
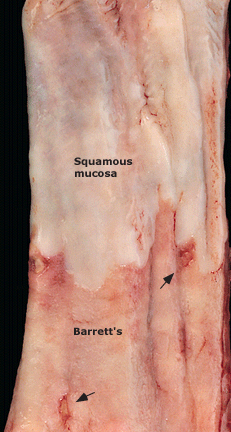
Muestra de esofagectomía en un paciente con displasia de alto grado durante la vigilancia endoscópica. La mucosa de Barrett de color salmón ha reemplazado circunferencialmente a la mucosa escamosa. Las erosiones dispersas son visibles (flechas).
Prevalencia en México.
La prevalencia en México del EB en la población general es de 0.26 a 9% con un promedio de edad de 57.3 ± 17 años; 69% pertenece al género masculino. Esta prevalencia se incrementa en pacientes con ERGE de más de 10 años de antigüedad y en personas mayores de 50 años de edad con ERGE.
Lesión inicial y evolución
Los cambios relacionados con el esófago de Barrett se inician a partir de una alteración crónica (secundaria a reflujo), en la cual se reemplaza el epitelio escamoso por epitelio columnar especializado con células caliciformes (metaplasia intestinal); cuando éste es mayor de 3 cm de extensión se denomina Barrett de segmento largo y cuando es menor de 3 cm de extensión Barrett de segmento corto. (esófago de barrett corto y largo)
El EB ocurre de preferencia en hombres y mujeres de raza blanca. Es menos frecuente en individuos afroamericanos, lo que sugiere una predisposición genética. Se cree que la célula donde se origina el EB tiene su inicio en células pluripotenciales de la capa basal del epitelio escamoso del esófago, lo cual provoca un cambio a epitelio intestinal (metaplasia). Este epitelio especializado es más resistente al ácido y se considera como un mecanismo protector. Los pacientes con EB tienen mayor tendencia a no mostrar síntomas y desarrollan menos síntomas o tardan más tiempo en aparecer con pruebas de inducción. Aunque el EB se considera un mecanismo protector adaptativo, eleva el riesgo de adenocarcinoma sobre la población general. Hoy día, el adenocarcinoma se considera como el tipo histológico más frecuente de cáncer de esófago y sobrepasa con mucho al carcinoma epidermoide o escamoso.
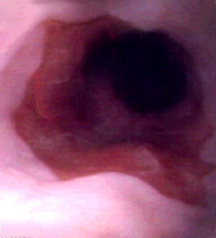
La endoscopia muestra segmentos largos de epitelio columnar que se extienden muy por encima de la unión esofagogástrica. Esta es la apariencia endoscópica característica del esófago de Barrett.
Factores de riesgo
Los factores de riesgo que se han relacionado con EB son los siguientes:
- a) Sexo masculino.
- b) Raza blanca (anglosajones).
- c) Edad >50 años.
- d) Antecedentes crónicos de ERGE (>5 años).
- e) ERGE con síntomas de predominio nocturno.
- f) Complicaciones del ERGE (estenosis, ulceración).
- g) Factores hereditarios.
Diagnostico de Esófago de Barrett
El diagnóstico de EB se sospecha mediante los datos endoscópicos y se confirma con la histopatología, al evidenciar metaplasia intestinal en el epitelio esofágico. Requiere toma de biopsias de forma sistemática en la mucosa esofágica de apariencia anormal. Es esencial identificar la unión escamocolumnar y la unión esofagogástrica. Cuando la unión de los epitelios escamocolumnar está desplazada de forma proximal a la unión esofagogástrica, el EB puede estar presente; puede confundirse con esofagitis erosiva o eritema del esófago, por lo que la biopsia es esencial para el diagnóstico.
El rendimiento diagnóstico de los procedimientos endoscópicos se puede incrementar con el uso de cromoendoscopia con tinciones vitales, como azul de metileno, azul tolueno e índigo carmín; sin embargo, estas técnicas son tediosas, consumen tiempo y no son reproducibles por todos los endoscopistas; en consecuencia, se ha desarrollado tecnología de magnificación como los endoscopios de banda angosta (NBI, por sus siglas en inglés), microendoscopia y otras técnicas como la espectroscopia.
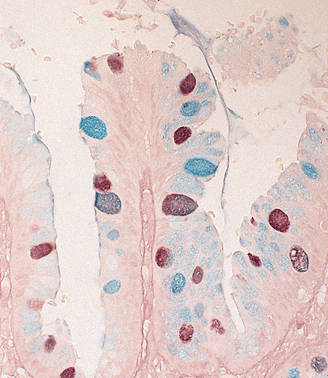
La vista de alta potencia de una muestra de biopsia de un paciente con esófago de Barrett se ha teñido con diamina. Esta tinción muestra células caliciformes que contienen mucinas sulfatadas (marrón) y mucinas no sulfatadas (azul).
Tratamiento del esófago de Barrett
Las medidas terapéuticas del EB sin displasia se enfocan en combatir el reflujo gastroesofágico. Incluyen las modificaciones del estilo de vida (disminución de sobrepeso, evitar alimentos que reducen la presión del esfínter esofágico inferior, apartarse del consumo de alcohol y tabaco, entre otros). Es útil la administración de fármacos inhibidores de la bomba de protones y bloqueadores H2. En pacientes que son elegibles para procedimientos quirúrgicos se debe elegir la cirugía antirreflujo.
En EB es discutible si el control o normalización de la exposición ácida, ya sea con tratamiento médico o quirúrgico, es suficiente, ya que se ha observado que esto no revierte la metaplasia. Se puede establecer vigilancia mediante endoscopias periódicas con biopsias para la detección de displasia como medida preventiva de la transformación tumoral; si no existe displasia en dos endoscopias consecutivas con biopsia se recomienda seguimiento endoscópico cada tres años.
Complicaciones del esófago de barret
Esófago de Barrett con displasia
Cuando existe displasia con EB en una biopsia de esófago se recomienda confirmar la presencia de ésta mediante un segundo procedimiento (endoscopia y biopsia) y enviar las muestras a revisión con un patólogo experto. Una vez que se confirma la presencia de displasia, si ésta es de bajo grado se sugiere vigilancia endoscópica cada año y, en caso de displasia de grado alto, el tratamiento se halla bajo discusión por el bajo riesgo de progresión a cáncer.
La terapéutica habitual recomendada es la esofagectomía. Dada las elevadas morbilidad y mortalidad de este procedimiento han surgido otras opciones de tratamiento conservador, entre las cuales se encuentran las terapéuticas ablativas endoscópicas como la fotodinámica, con láser y el tratamiento con argón plasma.
Todas están disponibles, pero con la que se tiene mayor experiencia es la fotodinámica que consiste en la administración de un compuesto químico fotosensibilizador y aplicación de una fuente de luz a una longitud de onda de 630 nm que produce daño celular y destruye el segmento de Barrett tratado. Existen informes en las publicaciones médicas de una reducción del adenocarcinoma (28 contra 13%, p = 0.006) al compararse con el uso único de inhibidores de la bomba de protones. Los factores que están en contra de este tratamiento son el riesgo de estenosis (20% con uno solo contra 80% en varias sesiones) en los pacientes tratados y la probabilidad de no tratar las glándulas del Barrett submucoso que se encuentran bajo el epitelio escamos neoformado.
Otra alternativa es la resección endoscópica de la mucosa que ofrece una opción promisoria de tratamiento definitivo menos cruento. Se han desarrollado varias técnicas, entre ellas la resección multifragmentada con asa (similar a la polipectomía de pólipos sésiles) o con banda.
Cuando un paciente con displasia de grado alto no es apto para cirugía o no desea ser operado se puede instituir seguimiento endoscópico; se recomienda en displasia focal cada tres meses, pero si existe displasia multifocal o con irregularidad de la mucosa se indica intervención, como resección endoscópica o quirúrgica.
Vigilancia endoscópica
Antes de la endoscopia con toma de biopsias de vigilancia, los pacientes deben tratarse con inhibidores de la bomba de protones, ya que la presencia de inflamación activa puede producir atipia celular y ésta malinterpretarse como displasia.
La técnica de toma de biopsias recomendada es la de cuatro cuadrantes cada centímetro, ya que son necesarias múltiples biopsias por la naturaleza multifocal de la displasia. Se requiere toma de biopsia sistemática de la mucosa de apariencia anormal (de Barrett) y adicionales si se encuentran erosiones, ganglios, úlceras y estenosis.




