La miastenia gravis es un trastorno neuromuscular autoinmune caracterizado por debilidad motora fluctuante que afecta a los músculos oculares, bulbares, de las extremidades puede afectar músculos respiratorios. La debilidad se debe a un ataque inmunológico mediado por anticuerpos dirigido a proteínas en la membrana postsináptica de la unión neuromuscular (receptores de acetilcolina o proteínas asociadas a receptores). La miastenia gravis es el trastorno más común de la transmisión neuromuscular.
Epidemiología
La miastenia gravis tiene una prevalencia de 20 por 100.000 habitantes en los Estados Unidos. Exhibe un predominio femenino en los menores de 40 años y un predominio masculino en los mayores de 50 años. La miastenia gravis infantil es bastante poco frecuente en las poblaciones occidentales, pero es prevalente en los países asiáticos, con la participación de alrededor del 50% de los pacientes menores de 15 años. Por lo general, se presentan con síntomas de debilidad muscular extraocular.
Fisiopatología de miastenia gravis
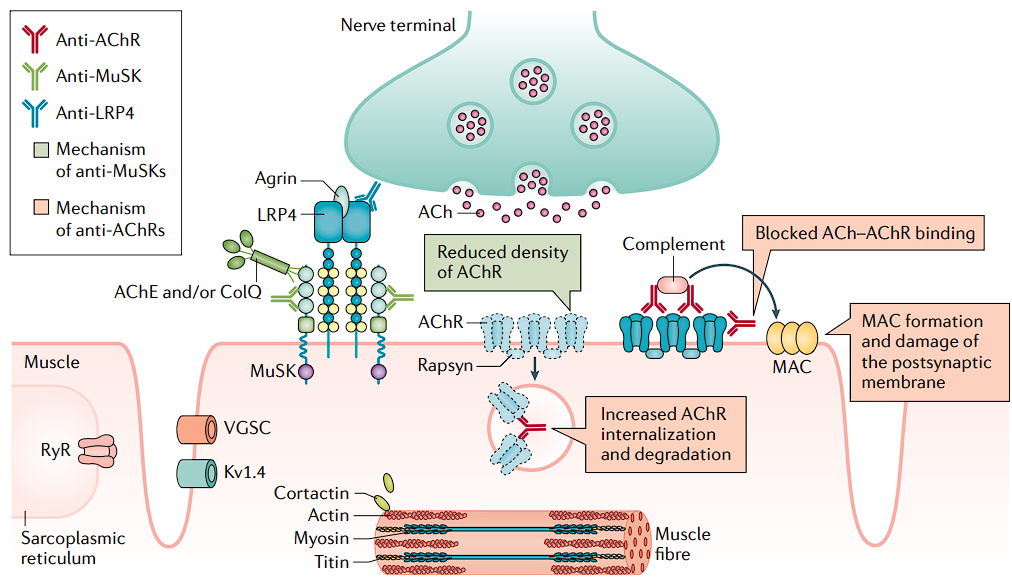
Los mecanismos fisiopatológicos en la MG dependen del tipo de anticuerpos presentes.
- Los anticuerpos n-AChR son del subtipo IgG1 e IgG3. Se unen al receptor n-ACh presente en la membrana postsináptica de los músculos esqueléticos y activan el sistema del complemento que conduce a la formación del complejo de ataque de membrana (MAC). MAC provoca la degradación final de los receptores. También pueden actuar bloqueando funcionalmente la unión de ACh a su receptor o mejorando la endocitosis del receptor n-ACh unido a anticuerpos.
- Los anticuerpos MusK MG y LPR4 son del subtipo IgG4 y no tienen la propiedad activadora del complemento. Se unen al complejo proteico Agrin-LRP4-MuSK. La inhibición del complejo conduce a un número reducido de receptores n-ACh. La ACh liberada en la terminal nerviosa, a su vez, no puede generar el potencial postsináptico requerido para generar un potencial de acción en el músculo debido a un número reducido de receptores n-ACh que conducen a los síntomas de debilidad muscular. La debilidad es más pronunciada con el uso repetido de un grupo muscular, ya que causa el agotamiento de la reserva de ACh.
Manifestaciones clínicas
Subtipos clínicos: hay dos formas clínicas de miastenia gravis:
- Ocular – La debilidad se limita a los párpados y músculos extraoculares.
- Generalizada: los síntomas implican una combinación variable de músculos oculares, bulbares, extremidades y respiratorios.
Clasificación de la enfermedad
La miastenia gravis se puede clasificar clínicamente de acuerdo con la extensión o gravedad de la debilidad muscular. El grado de deterioro progresa a través de categorías sucesivas desde debilidad que se limita a los músculos oculares, a debilidad que involucra a otros grupos musculares (por ejemplo, bulbar, axial, extremidad o músculos respiratorios), a insuficiencia respiratoria neuromuscular.
Debilidad muscular
La miastenia gravis se caracteriza por debilidad del músculo esquelético que fluctúa en el transcurso de un día y puede ser prominente o restringida a regiones musculares específicas.
Síntomas oculares
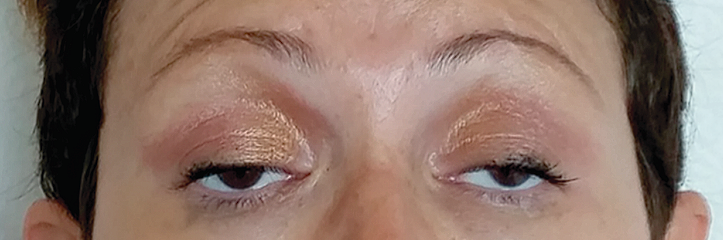
Los síntomas oculares son los más comunes y pueden incluir ptosis debido a la debilidad de los músculos palpebrales elevadores y diplopía debido a la debilidad de los músculos extraoculares.
Síntomas bulbares
La debilidad de los músculos orofaríngeos produce disartria o disfagia y es un contribuyente importante al riesgo de compromiso respiratorio debido a la aspiración. La debilidad de los músculos de expresión facial puede hacer que el paciente parezca inexpresivo.
Debilidad del cuello y las extremidades
Se puede encontrar debilidad de los músculos extensores y flexores del cuello y de las extremidades. El peso de la cabeza puede superar los extensores debilitados, produciendo un «síndrome de cabeza caída». La debilidad de las extremidades es típicamente proximal, similar a otras enfermedades musculares.
Síntomas respiratorios
La debilidad de los músculos de la respiración produce los síntomas más graves. La debilidad muscular respiratoria que conduce a insuficiencia respiratoria e insuficiencia respiratoria situación potencialmente mortal llamada «crisis miasténica». Puede ocurrir espontáneamente durante una fase activa de la enfermedad o puede precipitarse por una variedad de factores que incluyen cirugía, infecciones, ciertos medicamentos o disminución gradual de la inmunosupresión.
Fluctuación de los síntomas
La debilidad de los grupos musculares específicos afectados generalmente fluctúa, siendo leve o ausente en el día y más comúnmente peor más tarde o por la noche o después del ejercicio.
Progresión
Al principio del trastorno, los síntomas pueden ser episódicos, con intervalos asintomáticos que duran horas, días o incluso semanas. Con el tiempo, las manifestaciones suelen empeorar y volverse más persistentes. Los nuevos síntomas se desarrollan con frecuencia en las semanas o meses posteriores a la presentación inicial para pacientes con síntomas aislados. La progresión a la gravedad máxima generalmente alcanza su punto máximo dentro de unos pocos años del inicio de la enfermedad.
Pruebas clínicas
Se debe sospechar miastenia gravis en pacientes con debilidad muscular fatigable, incluidos aquellos con ptosis aislada y diplopía. Se pueden usar técnicas de examen específicas, como la prueba de la bolsa de hielo, para ayudar a localizar la debilidad motora de la unión neuromuscular.
Prueba de bolsa de hielo
La prueba de la bolsa de hielo se puede usar como parte del examen neurológico para pacientes con ptosis. La prueba se basa en el principio fisiológico de que la transmisión neuromuscular mejora a temperaturas musculares más bajas. En pacientes con miastenia gravis, la ptosis se puede superar temporalmente mediante el enfriamiento directo de los músculos del párpado.
Se coloca una bolsa llena de hielo (o guante quirúrgico) en un parpado cerrado durante dos minutos. Luego se retira el hielo y se vuelve a evaluar inmediatamente la extensión de la ptosis. La mejoría en la ptosis es un resultado positivo de la prueba. La sensibilidad parece ser de aproximadamente el 80 % en aquellos con ptosis prominente debido a miastenia gravis. No se ha establecido el valor predictivo de la prueba.
Por lo general, no es útil para aquellos con otros síntomas oculares, como debilidad muscular extraocular.
Pruebas farmacológicas
La administración de un agente farmacológico para potenciar la transmisión de señales de acetilcolina se puede usar para ayudar a localizar los síntomas de la unión neuromuscular para afecciones como la miastenia gravis caracterizada por una transmisión deficiente de acetilcolina.
Prueba de edrofonio
La prueba de edrofonio se describe por razones históricas, pero ha caído en desuso debido a la sensibilidad y especificidad subóptimas, así como a los riesgos adversos asociados.
El cloruro de edrophonio es un inhibidor de la acetilcolinesterasa con inicio rápido (30 a 45 segundos) y corta duración de acción (5 a 10 minutos). Este agente prolonga la presencia de acetilcolina en la unión neuromuscular y resulta en un aumento inmediato de la fuerza muscular en muchos de los músculos afectados.
La prueba de edrofonio, si está disponible, se usa para pacientes con ptosis u oftalmoparesis obvias, en quienes se puede observar fácilmente una mejoría después de la infusión del medicamento. El edrofonium se administra por vía intravenosa en dosis incrementales de 2 mg, generalmente hasta una dosis total de 10 mg. La clara mejoría de la ptosis u oftalmoparesis indica un resultado positivo. La sensibilidad de la prueba de edrofonio está en el rango de 80 a 90 %, pero puede producir resultados falsos negativos o falsos positivos.
Diagnóstico serológico
Para la mayoría de los pacientes con características clínicas de miastenia gravis, el diagnóstico se confirma por la presencia de autoanticuerpos contra el receptor de acetilcolina (AChR) o contra otras proteínas asociadas al receptor muscular (por ejemplo, tirosina quinasa específica del músculo [MuSK] o proteína 4 relacionada con el receptor de lipoproteínas de baja densidad [LRP4]).
Un ensayo inmunológico para detectar la presencia de anticuerpos AChR circulantes debe ser la prueba de laboratorio inicial realizada para confirmar el diagnóstico de miastenia gravis. Los anticuerpos AChR se encuentran en hasta el 90 % de los pacientes con MG generalizada.
Se pueden realizar pruebas serológicas para anticuerpos MuSK y LRP4 en pacientes con características clínicas de miastenia gravis que no tienen anticuerpos AChR.
Confirmación electrodiagnóstica
Se realizan estudios electrodiagnósticos para confirmar el diagnóstico de MG cuando la prueba inicial de autoanticuerpos serológicos es negativa y para excluir diagnósticos alternativos para pacientes con síntomas atípicos o seronegativos.
Las pruebas de electrodiagnóstico para miastenia gravis incluyen estudios de conducción nerviosa con estimulación nerviosa repetitiva (RNS), así como electromiografía (EMG), que se pueden realizar con la técnica EMG de fibra única (SFEMG).
Los estudios estimulación nerviosa repetitiva pueden identificar el deterioro de la transmisión neuromuscular cuando la estimulación repetida de un nervio motor muestra una reducción progresiva en la amplitud del potencial de acción muscular compuesto.
La técnica EMG de fibra única se realiza con un electrodo de aguja especializado que puede mostrar variabilidad en el tiempo entre los potenciales de acción de dos fibras musculares inervadas por el mismo axón motor para indicar deterioro en la transmisión neuromuscular.
Pruebas para excluir diagnósticos alternativos
Las pruebas de diagnóstico adicionales generalmente se reservan para pacientes seleccionados con características clínicas atípicas para excluir otras enfermedades en el diagnóstico diferencial de miastenia gravis. Las pruebas pueden incluir resonancia magnética cerebral, tomografía computarizada o ultrasonido de las órbitas y punción lumbar para análisis del líquido cefalorraquídeo.
Pruebas para afecciones asociadas
Todos los pacientes diagnosticados con miastenia gravis deben ser evaluados para detectar afecciones asociadas, como timomas u otras afecciones autoinmunes. La timectomía está indicada para pacientes con miastenia gravis y un timoma. Además, sugerimos examinar a todos los pacientes para detectar enfermedad tiroidea autoinmune.
Pronóstico
El pronóstico de miastenia gravis varía según la gravedad de los síntomas y la respuesta al tratamiento. El control inadecuado de los síntomas, la crisis miasténica, la edad avanzada en el momento del diagnóstico y la presencia de timoma se asocian con un resultado deficiente.
Tratamiento miastenia gravis
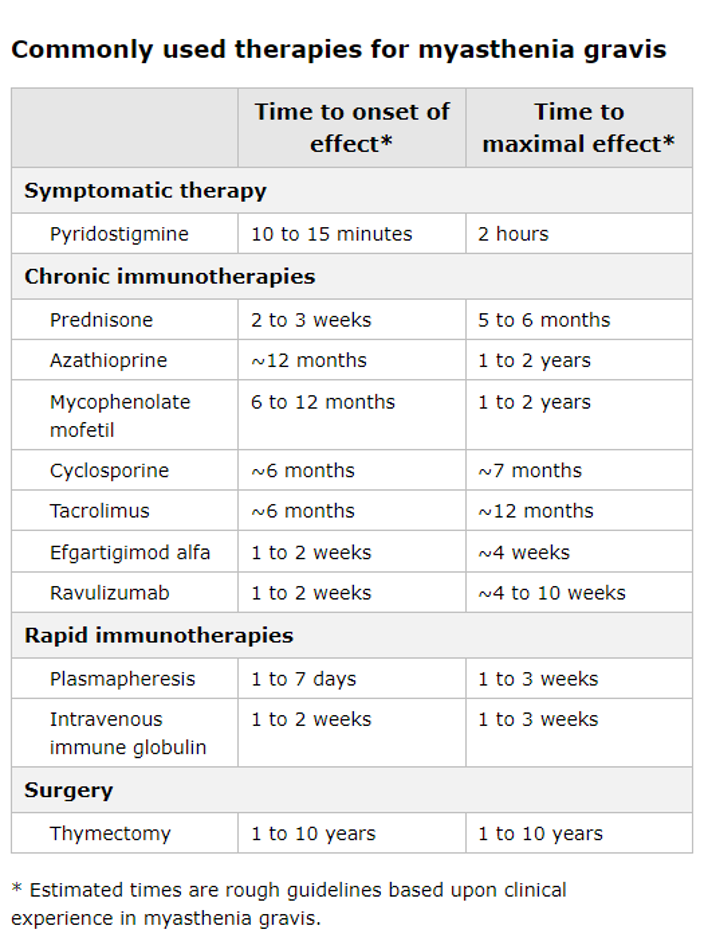
Los objetivos de la terapia en miastenia gravis son hacer que los pacientes sean mínimamente sintomáticos, al tiempo que minimizan los efectos secundarios de los medicamentos. Las cuatro terapias básicas para la miastenia gravis incluyen:
Tratamiento sintomático con un inhibidor de la acetilcolinesterasa (piridostigmina)
Inmunoterapias crónicas
Terapias inmunomoduladoras rápidas pero transitorias (recambio plasmático e inmunoglobulina intravenosa IGIV)
Timectomia
El tiempo de inicio del efecto clínico de cada una de estas terapias varía considerablemente.
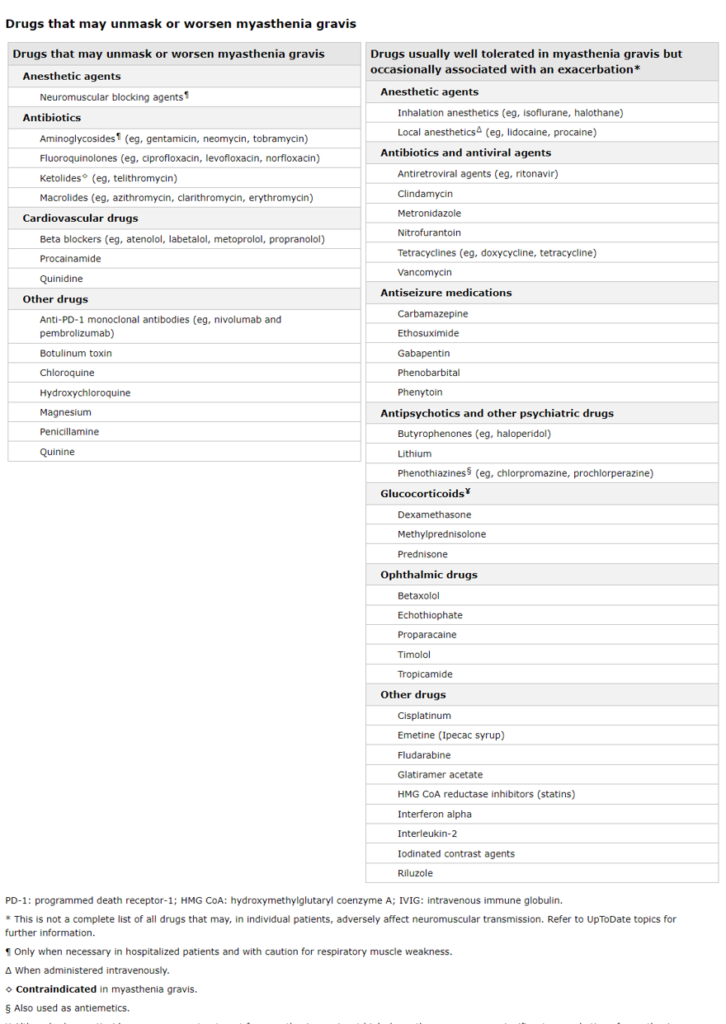
Evite los medicamentos que pueden exacerbar la miastenia gravis
Algunos medicamentos deben evitarse porque pueden reducir la efectividad de la transmisión neuromuscular y causar una mayor debilidad clínica
Vacunación de rutina
La administración de la vacuna contra la influenza estacional y la vacuna antineumocócica está indicada para mitigar el riesgo de compromiso respiratorio y crisis miasténica que pueden ocurrir con infecciones respiratorias. Los pacientes que reciben tratamiento con terapia inmunosupresora no deben recibir la vacuna contra la influenza con virus vivos atenuados ni las vacunas vivas atenuadas contra la varicela o el zóster.
Terapia sintomática inicial
La terapia sintomática inicial consiste en un inhibidor de la acetilcolinesterasa como la piridostigmina oral. La piridostigmina sola proporciona una mejoría marcada en algunos paciente.
Una dosis inicial típica de piridostigmina para adultos y adolescentes mayores es de 30 mg tres veces al día. Para niños y adolescentes más jóvenes, la dosis inicial es de 0,5 a 1 mg/kg cada cuatro a seis horas. La dosis de piridostigmina se ajusta por su efecto.
Inmunoterapia
La mayoría de los pacientes con miastenia gravis generalizada requieren terapia adicional dirigida a la desregulación inmune subyacente. Los glucocorticoides y otras inmunoterapias están indicados para pacientes que permanecen significativamente sintomáticos con piridostigmina.
El papel de la timectomía
En paralelo con el tratamiento sintomático con piridostigmina y los agentes inmunoterapéuticos, la timectomía tiene un papel terapéutico para los pacientes con timoma, así como para los pacientes seleccionados.
Exacerbaciones
El empeoramiento transitorio de los síntomas miasténicos puede precipitarse por infección concurrente, cirugía, embarazo, parto, medicamentos, disminución gradual de medicamentos inmunoterapéuticos o espontáneamente como parte de la historia natural de la enfermedad.
Cuando es grave, los pacientes corren el riesgo de insuficiencia respiratoria potencialmente mortal conocida como crisis miasténica.
El intercambio plasmático terapéutico (plasmaféresis) y la IgIV funcionan rápidamente, pero tienen una corta duración de acción. Se utilizan para tratar la crisis miasténica, el tratamiento prequirúrgico de la miastenia gravis moderada a grave, como un «puente» al iniciar inmunoterapias de acción más lenta, y como adyuvantes periódicos a otros medicamentos inmunoterapéuticos.
Enlace interno
Neurología » Medical & Gabeents
Enlace externo
Practice Advisory: Thymectomy for Myasthenia Gravis (Practice Parameter Update) (aan.com)


[…] amiotrofia monomélica, paraplejia espástica hereditaria, atrofia muscular espinobulbar, miastenia gravis e […]